题目内容
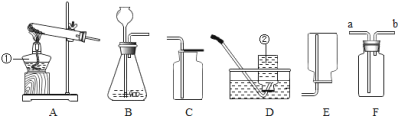
【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
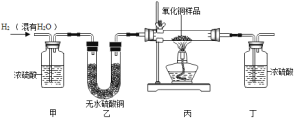
(1)实验中,乙装置的作用是______。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.4克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度___(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是______。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收
【答案】检验氢气中混有的水是否全部被浓硫酸吸收 80% B
【解析】
(1)实验中,乙装置的作用是:检验氢气中混有的水是否全部被浓硫酸吸收;
(2)设参加反应的氧化铜的质量为x。
根据浓硫酸增加的质量可知,生成的水的量为:163.9g-161.2g=2.7g,
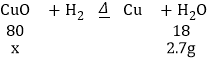
![]()
x=12g
氧化铜的纯度为:![]() ×100%=80%
×100%=80%
答:氧化铜的纯度为80%。
(3)A.装置的气密性不好,导致计算的水的质量偏小,从而导致氧化铜的质量分数偏小,选项错误;
B.空气中的水分被丁处浓硫酸吸收,导致计算的水的质量偏大,从而导致计算的氧化铜质量分数偏大,选项正确;
C.通入的氢气量不足,导致水的质量偏小,从而导致氧化铜的质量分数偏小,选项错误;
D.空气中的二氧化碳不能被丁处浓硫酸吸收,不影响结果,选项错误。
故填:B。

【题目】某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量 /g | m | 58.4 | 82.6 | 107.6 |
求:(1)生成二氧化碳的总质量是_____g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是_____g。
(3)该石灰石样品中碳酸钙的质量分数为________。(写出计算过程)