题目内容
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )
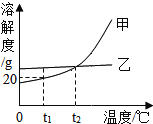
A. 甲的溶解度比乙大
B. t2℃时,甲、乙的饱和溶液中溶质的质量相等
C. t1℃时,在50g水中加入15g甲,可得到 65g 溶液
D. 要使接近饱和的甲溶液转化为饱和溶液,可采用降温的方法
【答案】D
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、t2℃时,甲、乙物质的溶解度相等,所以等质量的甲、乙饱和溶液中溶质的质量相等,故B错误;
C、t1℃时,甲物质的溶解度是20g,所以在50g水中加入15g甲,可得到60g溶液,故C错误;
D、甲物质的溶解度随温度的升高而增大,所以要使接近饱和的甲溶液转化为饱和溶液,可采用降温的方法,故D正确。
故选D。

【题目】实验小组同学做了如下实验,验证质量守恒定律。
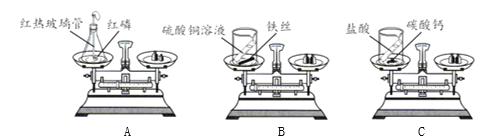
(1)实验A中发生反应的化学方程式为_______。
(2)上述实验中,不能用于验证质量守恒定律的是______(填实验序号),其原因是______。
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
(提出问题1) KI变质的条件是什么?
(查阅资料)
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
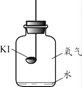
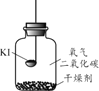
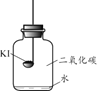
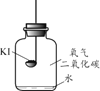
(进行实验)分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
(解释与结论)
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
(4)CO2的作用是______。
【题目】三氯化铁(FeCl3)用于金属蚀刻等。化学兴趣小组想把铁燃烧产物转化成FeCl3。 请根据装置如图回答问题:
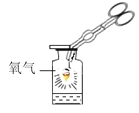
(1)写出铁在氧气中燃烧的化学方程式____。
探究一:铁丝在氧气中燃烧为什么会火星四射?
(查阅资料)
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时 的现象 | 剧烈燃烧,发白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 大量火星 |
(2)由上表可知铁丝燃烧能否产生火星与该物质____有关。
探究二:铁丝燃烧时溅落的黑色物质的成分
(查阅资料)Fe3O4能与稀盐酸反应生成可溶于水的FeCl2和FeCl3,溶液呈黄色。反应的方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O。
(实验探究)将溅落的黑色物质碾碎,加入足量稀盐酸。
(3)观察到黑色固体逐渐溶解,溶液变成黄色,同时有气泡生成,写出产生气泡的化学方程式____。
(实验结论)
(4)由以上现象可得,铁燃烧时溅落的黑色物质含有____。
(5)反应完全后,发现还有固体残渣,你认为该残渣可能是____。
探究三:三氯化铁的制取与应用
(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2。
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
将探究二所得剩余物,通过分步实验,操作过程中氯化铁的质量变化如图16:
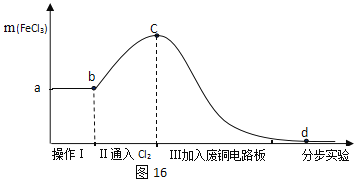
(6)操作Ⅰ可除去固体残渣,该操作的名称是____。
(7)通过操作Ⅱ,氯化铁的质量增加的原因是____(用化学方程式来表示)。
(8) 通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是____。