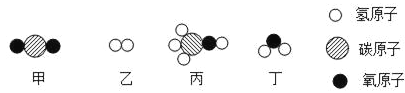
题目内容
【题目】氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
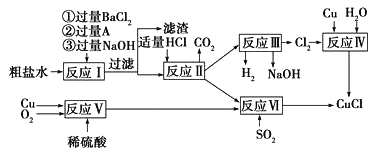
⑴A溶液中溶质的化学式是______________;
⑵写出反应III的化学方程式_________;
⑶反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是____;
⑷本工艺中可循环利用的物质是_______________;
⑸反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。70℃真空干燥的目的是___________。
【答案】 ![]()
![]() S(或硫)
S(或硫) ![]() 与
与![]() 防止
防止![]() 被氧化,加快乙醇与水的蒸发(答不全不给分)
被氧化,加快乙醇与水的蒸发(答不全不给分)
【解析】(1)加入氯化钡溶液可以除去硫酸根离子,加入碳酸钠溶液可以除去钙离子和过量的钡离子,加入氢氧化钠溶液可以除去镁离子,因此A溶液是碳酸钠溶液,碳酸钠的化学式是Na2CO3;(2)反应III中,电解饱和食盐水时,氯化钠和水反应生成氢氧化钠、氢气和氯气,反应的化学方程式为: ![]() ;(3)反应2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4中,氯化钠中钠元素的化合价是+1,氯元素的化合价都是1,硫酸铜中铜元素的化合价是+2,硫元素的化合价是+6,氧元素的化合价是2,二氧化硫中硫元素化合价是-4,氧元素化合价是2,水中氢元素化合价是+1,氧元素化合价是2,氯化亚铜中铜元素的化合价是+1,氯元素化合价是1,硫酸中氢元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是2,硫酸钠中钠元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是2,因此反应中化合价升高的元素是硫元素,由+4变成+6,故反应中化合价升高的元素是S;(4)本工艺中可循环利用的物质是NaOH、H2SO4,电解生成的氢氧化钠可应用于反应Ⅰ,反应VI中生成的硫酸可应用于反应Ⅴ; (5)70℃真空干燥的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。
;(3)反应2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4中,氯化钠中钠元素的化合价是+1,氯元素的化合价都是1,硫酸铜中铜元素的化合价是+2,硫元素的化合价是+6,氧元素的化合价是2,二氧化硫中硫元素化合价是-4,氧元素化合价是2,水中氢元素化合价是+1,氧元素化合价是2,氯化亚铜中铜元素的化合价是+1,氯元素化合价是1,硫酸中氢元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是2,硫酸钠中钠元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是2,因此反应中化合价升高的元素是硫元素,由+4变成+6,故反应中化合价升高的元素是S;(4)本工艺中可循环利用的物质是NaOH、H2SO4,电解生成的氢氧化钠可应用于反应Ⅰ,反应VI中生成的硫酸可应用于反应Ⅴ; (5)70℃真空干燥的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。

 阅读快车系列答案
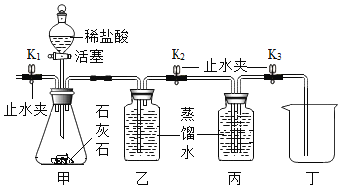
阅读快车系列答案【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
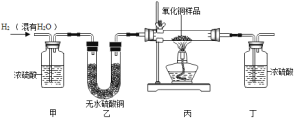
(1)实验中,乙装置的作用是______。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.4克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度___(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是______。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收
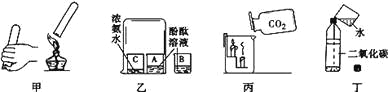
【题目】下列归纳和总结完全正确的一组是![]()
![]()
A.对鉴别的认识 | B.化学与生活 |
|
|
C.化学与资源 | D.化学与安全 |
|
|
A. AB. BC. CD. D