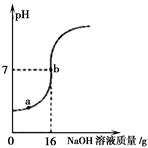
题目内容
为测定某含有少量NaCl的纯碱晶体(Na2CO3?nH2O)样品的组成,做了如下实验:
根据实验数据进行计算,写出计算过程。
(1)样品中含有结晶水的质量是 克。
(2)原混合物中NaCl与纯碱晶体(Na2CO3?nH2O)的质量比 。
(3)化学式Na2CO3? nH2O中n= 。
(1) 6.3g (2)5 : 116 (3)7
解析试题分析:加热时水会蒸发到空气中,减少的质量则为水的质量;
利用化学方程式盐酸与碳酸钠反应的质量比可求出碳酸钠的质量;
根据物质的质量比等于相对分子质量之比,可求出n的值。
(1)样品中含有结晶水的质量=12.1g-5.8g=6.3g
(2)稀盐酸中溶质的质量=36.5×10%=3.65g
Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
71
X 3.65g
106/71 =x/3.65g
X=5.3g
那么纯碱晶体的质量=12.1g-5.3g-6.3g=0.5g
故原混合物中NaCl与纯碱晶体(Na2CO3?nH2O)的质量比=0.5g:(5.3g+6.3g)
="0.5" : 11.6
=5:116
(3)纯碱晶体中,碳酸钠的质量为5.3g,水的质量为6.3g,质量比为相对分子质量之比,
故106:18n=5.3g:6.3g,则n=7
答:略
考点:利用化学方程式的计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
(1)写出第四次实验后溶液中溶质的化学式____________;
(2)写出第二次实验中反应的化学方程式___________________________________;
(3)根据已知条件,列出求解参加反应的碳酸钠质量(x)的比例式_____________;
(4)所用稀盐酸的溶质质量分数为___________;
(5)该氢氧化钠溶液中变质的氢氧化钠与剩余氢氧化钠的质量比为______________;
(6)第三次反应后的溶液中,再加入5.88g水,所得溶液中溶质的质量分数为_____。
(8分)
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:
(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?
| | 空烧杯 | 加入硫酸后 | 加入合金后 5分钟 | 加入合金后 10分钟 | 加入合金后 30分钟 |
| 读数(g) | 21.3 | 169.7 | 184.6 | 184.3 | 184.3 |