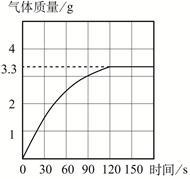
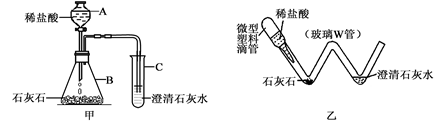
题目内容
(3分)28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl = AgCl↓+ NaNO3;计算结果精确到1%)
32%
解析试题分析:根据质量守恒定律:化学反应前后的质量不变,可以判断反应生成沉淀的质量为:28.7g+100g+134g-234g=28.7g,再根据化学反应:AgNO3 + NaCl = AgCl↓+ NaNO3中AgCl和NaCl的质量关系,算出NaCl的质量,从而也可算出硝酸钠,再根据元素的质量=物质的质量×元素的质量分数,即可算出钠元素的质量,进而可求出原混合物中钠元素的质量分数
解:设混合物中氯化钠的质量是x
生成沉淀的质量是:(28.7g + 100g + 134g)﹣234 g =" 28.7" g
NaCl + AgNO3 = AgCl↓+ NaNO3
58.5 143.5
x 28.7 g
58.5g:143.5g=x:28.7g
∴x=11.7g 则原混合物中硝酸钠的质量=28.7g-11.7g=17g
故原混合物中钠元素=11.7g×23/58.5×100% + 17g×23/85×100%=9.2g
原混合物中钠元素的质量分数=9.2g/28.7g×100%=32%
答:原混合物中钠元素的质量分数为32%
考点:根据化学式、化学方程式进行计算

(7分) 某学生做了如下图所示的实验。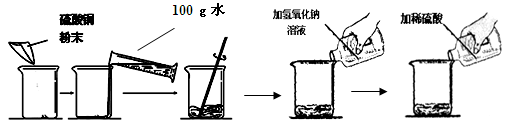
| | 第一次 | 第二次 |
| 加入硫酸铜的质量 | m | m |
| 加入氢氧化钠溶液的质量 | 50g(溶质质量分数16%) | 50g(溶质质量分数16%) |
| 加入稀硫酸的质量 | 50g | 100g |
| 实验现象 | 蓝色固体和蓝色溶液 | 蓝色溶液 |
若第二次所加物质恰好完全反应(溶液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式___________________________;
(2)第一次实验后的溶液中所含溶质的化学式为___________________________;
(3)根据已知条件列出求解实验中生成沉淀的质量(x)的比例式______;
(4)实验中加入硫酸铜的质量(m)为______;
(5)在第二次实验中,若向加入氢氧化钠溶液反应后的滤液中加入43.8 g水,则所得溶液中溶质的质量分数为_____________;
(6)若用溶质质量分数为98%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量为_________。
(6分)课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
A.蒸发时未用玻璃棒搅拌 B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热 D.实验后未将玻璃棒上的白色固体移入蒸发皿
有一种石灰石样品的成分是CaCO3和SiO2。课外小组同学将100g盐酸分5次加入到35g该石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图像:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
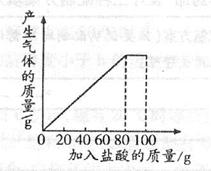
请计算:
(1)第2次加入盐酸后,a为 g;
(2)石灰石样品中碳酸钙的质量分数;(计算结果精确至0.1%)
(3)10%的CaCl2溶液可做路面保湿剂。欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)(计算结果精确至0.1g)