题目内容
【题目】小明发现过氧化钠(Na2O2)一种淡黄色的粉末可以用于杀菌、消毒和漂白,Na2O2能与水反应,生成气体并放出大量的热。于是想探究它与水反应后产生的气体是什么?
(猜想与假设)对生成的气体成分进行判断,他提出了以下三种假设:
A.该气体是CO2
B.该气体是O2
C.该气体是H2
(1)同学们首先一致认为上述假设中的_____(填“A”或“B”或“C”)肯定不合理,理由是_____。
(设计实验方案)取少量过氧化钠固体粉末于试管中,加2mL水,振荡并观察现象。
(实验验证并得出结论)
立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠。
(2)通过查阅资料,同学们又得知:在化学反应中,有元素化合价升高,就必然有元素化合价降低。于是通过小组讨论,大家一致认为上述假设中的_____(填“A”或“B”或“C”)肯定也不合理。
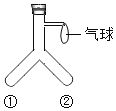
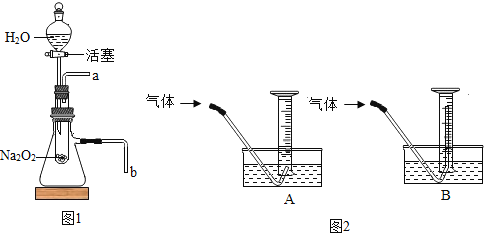
(3)同学们用图1装置(装置气密性良好)进行实验并检验,验证了上述分析的合理性:
操作步骤 | 实验现象 | 结论 |
取少量固体粉末于试管中,打开活塞使水流入试管,将带火星的木条放在图1中的导管_____(填“a”或“b”)处 | 带火星木条复燃 | 证明是该气体是O2 |
(4)写出过氧化钠与水反应的化学方程式_____。
(交流与反思)
(5)小王同学用图2装置,测量生成氧气的体积;测量气体体积读数时,必须待试管和量筒内的气体都冷却至室温时才能进行,因此应选用图2装置中的_____(填“A”或“B”),否则测量结果会_____(填偏大”或“偏小”)。
【答案】A 反应物中不含有碳元素,不能生成二氧化碳 C a 2Na2O2+2H2O=4NaOH+O2↑ A 偏大
【解析】
(1)同学们首先一致认为上述假设中的A肯定不合理,理由是反应物中不含有碳元素,不能生成二氧化碳;
(2)大家一致认为上述假设中的C肯定也不合理,这是因为过氧化钠中氧元素化合价是﹣1,生成的氢氧化钠中氧元素化合价是﹣2,氧元素化合价降低,如果生成氢气,氢气中氢元素化合价是0,反应物水中氢元素化合价是+1,反应后化合价降低,这是不可能的;
(3)取少量固体粉末于试管中,打开活塞使水流入试管,将带火星的木条放在图1中的导管a处,带火星的木条复燃,证明是该气体是氧气;
(4)过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
(5)应选用图2装置中的A,否则测量结果会偏大,这是因为B中导管伸入太长,会导致排出的水的体积偏大。