题目内容
【题目】科技推动着奥林匹克运动的发展,在奥运会中化学的表现十分突出。

(1)“鸟巢”的建造中使用了大量的钢铁。生产这些钢铁时要在高温条件下将Fe2O3用一氧化碳还原成铁,其反应的化学方程式为_____________________。
(2)“水立方”的膜结构是由化学合成材料ETFT制成的,化学式是(C2H2F2)n ,则其相对分子质量的计算式是_____________________________。
(3)撑杆跳高使用的玻璃纤维杆,其主要成分是SiO2、Al2O3等,在物质分类中它们属于______(填序号)。
A.单质 B.化合物 C.氧化物
(4)采集奥林匹克圣火的唯一方式,是在奥林匹克的赫拉神庙前通过太阳光集中在凹面镜的中央,引燃圣火。此过程中最关键的燃烧条件是_______________________。
(5)奥运会需要大量的能量。物质发生化学反应的同时,伴随着能量的变化,通常表现为_______的变化。太阳能、_______、_______、_______、潮汐能等新能源的广泛开发利用还有待于研究。
【答案】 Fe2O3+3CO![]() 2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能 风能 地热能
2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能 风能 地热能
【解析】(1)炼铁是用三氧化二铁和一氧化碳在高温的条件下反应生成二氧化碳和铁,反应方程式为:Fe2O3+3CO 高温2Fe+3CO2;
(2)ETFT的化学式是(C2H2F2)n,其相对分子质量为:(12![]() )
)![]() n;
n;
(3)SiO2、Al2O3都是由两种元素组成,一种元素为氧元素的化合物,故他们都是氧化物,又是化合物,故选BC;
(4)该过程是可燃物燃烧的过程,条件中已经有了可燃物和氧气,另外一个关键的条件就是通过凹面镜的聚光使温度达到可燃物的着火点;
(5)物质发生化学变化的过程中同时伴随有能量的变化,体现在温度的变化;我们还可以利用太阳能、核能 、风能 、地热能、潮汐能等新能源。

【题目】化学兴趣小组对“影响过氧化氢分解反应速率的因素﹣﹣过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为 .
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是 , 氧气应从(选填e或f)管通入,再与g相连.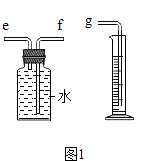
(3)【数据处理】
实验小组进行实验后,获得的相关实验数据如表所示:
实验编号 | 过氧化氢的质量分数 | 二氧化锰粉末 | 氧气的体积(mL) |
a | 5% | 0.2g | 65.8 |
b | 5% | 0.8g | 85.7 |
c | 5% | 1.0g | 85.7 |
d | 10% | 0.2g | 121.9 |
e | 10% | 0.8g | 171.5 |
f | 10% | 1.0g | 171.5 |
①若要检验上述实验收集到的气体是否为氧气,方法是 .
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数 .
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越 .
(4)【拓展延伸】
如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是 . 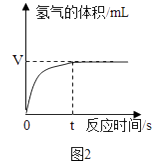
(5)你认为影响过氧化氢分解反应速率的因素还有 , 请设计实验方案验证你的猜想 .