题目内容
【题目】碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡。
现象:溶液变成浅红色.由此得出结论①__________________________;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为②_____________________;
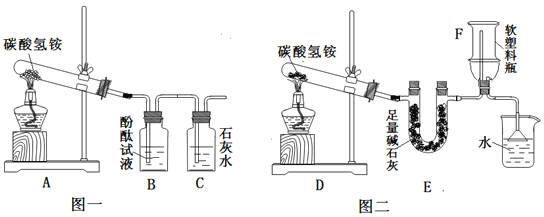
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如下所示装置进行实验
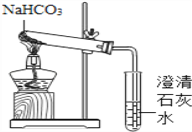
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,清石灰石变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).步骤③______________________,现象④_________________________。
(2)写出碳酸氢钠受热分解的化学方程式⑤________________________________________
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途⑥___________________________。
【答案】 NaHCO3溶液显碱性 固体溶解,有大量气泡产生 取样,加水溶解滴加氯化钙(氯化钡)溶液 有白色沉淀产生 2NaHCO3![]() Na2CO3+CO2↑+ H2O 治疗胃酸过多(合理即可)
Na2CO3+CO2↑+ H2O 治疗胃酸过多(合理即可)
【解析】(1). 酚酞试液是常用的酸碱指示剂,遇碱性溶液变红,遇酸性或中性溶液不变色;向碳酸氢钠溶液中滴入几滴酚酞,试液变成红色,说明碳酸氢钠溶液呈碱性 ; (2). 碳酸氢钠也盐酸反应生成氯化钠、二氧化碳、水,所以向碳酸氢钠溶液中加入盐酸后,观察到产生气泡 (3). 碳酸钠能与氢氧化钙(或氯化钙)溶液反应生成沉淀,而氢氧化钠不能,证明试管中留下的白色固体是Na2CO3,而不是NaOH的方法是:取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水 (4). 有白色沉淀生成 说明是碳酸钠,(也可以取少量该固体加入试管中,加入稀盐酸,有气泡产生则说明是碳酸钠而不是氢氧化钠) (5). 碳酸氢钠在加热条件下分解生成碳酸钠、二氧化碳、水,方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑ (6). 由于碳酸氢钠能与盐酸反应生成氯化钠和水、二氧化碳,所以可用来治疗胃酸。
Na2CO3+H2O+CO2↑ (6). 由于碳酸氢钠能与盐酸反应生成氯化钠和水、二氧化碳,所以可用来治疗胃酸。

【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
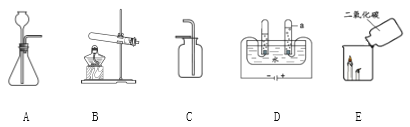
A | B |
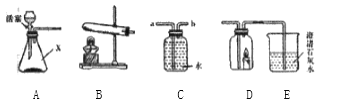
(1)实验室用高锰酸钾制取氧气,选取的发生装置是______。 (2)实验室用高锰酸钾制取氧气的化学方程式为___________________。 (3)D中试管a中产生的气为____。 | (1)实验室制取二氧化碳,选取的发生装置是______。 (2)实验室制取二氧化碳的化学方程式为________________。 (3)E中观察到的现象是________。 |
【题目】实验室用铜辉矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备某种碱式碳酸铜【Cua(OH)b(CO3)cdH2O】的主要实验流程如下图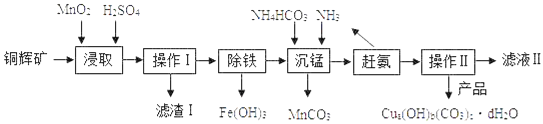
(1)实验室进行操作I和操作II时,用到的玻璃仪器有:玻璃棒、烧杯和__________。
(2)“浸取”步骤中发生反应(I、II),其中反应I为:2MnO2+Cu2S+□H2SO4=2MnSO4+2CuSO4+S↓+4H2O,在□中的化学计量数是________。
(3)“浸取”步骤中,另一反应II的化学方程式为________________。
(4)滤渣I的成分为MnO2、S和___________。
(5)已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
开始沉淀 | 7.5 | 2.7 | 5.2 | 8.3 |
完全沉淀 | 9.7 | 3.2 | 6.4 | 9.8 |
“除铁”步骤中,控制适宜的pH范围为_____________。