题目内容
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
Ⅰ.(镍粉制备):
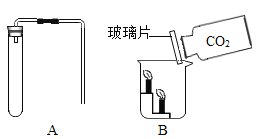
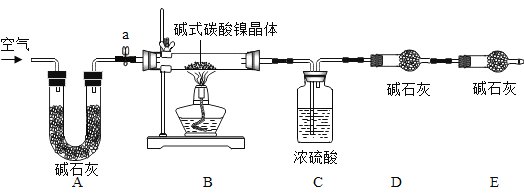
工业用电解镍新液(主要含NiSO4、NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],并利用其制备镍粉的流程如下:
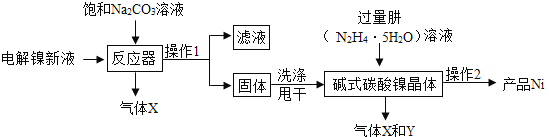
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2CO2↑,生成的气体直接排放对环境的影响是___________。
(2)物料在反应器中反应时需要控制反应条件。
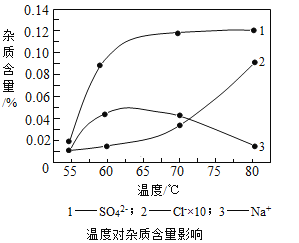
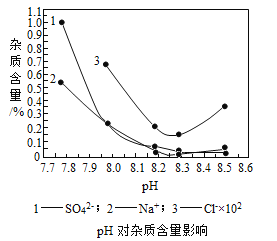
分析上图,反应器中最适合的温度及pH分别为__________、8.3。
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将_____________(填“升高”、“降低”或“不变”)。
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作。其中使用95%酒精浸泡的目的是_________
Ⅱ.(测定碱式碳酸镍晶体的组成):
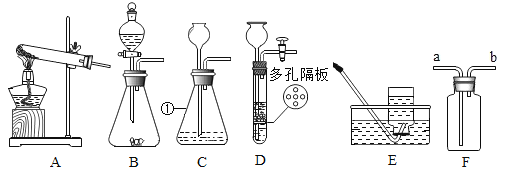
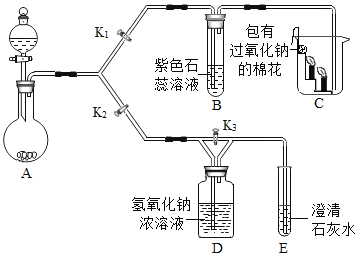
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如下实验方案及装置:
(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称取7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 252.16 | 190.88 | 190.00 |
(实验分析及数据处理)
(5)实验过程中步骤③鼓入空气的目的是__________。装置A的作用是______。
(6)计算7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]完全分解中镍元素的质量__。最终通过计算得到了碱式碳酸镍晶体的组成,x:y:z=_______
(实验反思)
(7)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显偏大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会部分被氧化成Ni2O3。 该组同学称得的残留固体混合物的质量可能是_____________。
A 4.5g B 4.6g C 4.98g D 5.2g
【答案】温室效应 55℃ 升高 便于快速晾干 排尽装置中原有的CO2和水蒸气 除去进入装置的空气中的CO2和水蒸气 3.54 1:2:4 B
【解析】
(1)生成的气体是二氧化碳,二氧化碳会造成“温室效应”;
(2)由图可知,反应器中温度为55℃、pH为8.3时,杂质含量最低,故填:55℃;
(3)Ni(OH)2中Ni的质量分数为:![]() ,碳酸镍中镍的质量分数为:
,碳酸镍中镍的质量分数为:![]() ,氢氧化镍中镍的含量比碳酸镍中镍的含量高,故生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将升高;
,氢氧化镍中镍的含量比碳酸镍中镍的含量高,故生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将升高;
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作。其中使用95%酒精浸泡的目的是:酒精易挥发,便于快速晾干;
(5)实验过程中步骤③鼓入空气的目的是:排尽装置中原有的CO2和水蒸气;
装置A的作用是:除去进入装置的空气中的CO2和水蒸气,防止对实验结果的测定造成影响;
(6)碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O,反应生成水的质量是:252.16g-250.00g=2.16g,反应生成二氧化碳的质量是:190.88g-190.00g=0.88g,根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,生成NiO的质量为:7.54g-0.88g-2.16g=4.5g,故镍元素的质量为:![]() ;
;
碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O,该反应的化学方程式为:
![]() ,
,
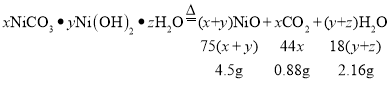
![]() y=2x
y=2x
![]() z=2y
z=2y
故x:y:z=1:2:4;
(7)如果生成的固体全部都是Ni2O3,则Ni2O3的质量为:![]() ,如果全部是NiO,质量为4.5g,NiO会部分被氧化成Ni2O3。故称得的残留固体混合物的质量是4.5g~4.98g。
,如果全部是NiO,质量为4.5g,NiO会部分被氧化成Ni2O3。故称得的残留固体混合物的质量是4.5g~4.98g。
故选B。

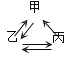
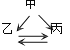
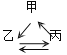
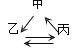
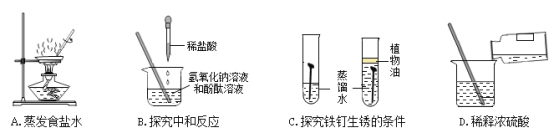
【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是( )
选项 | A. | B. | C. | D. | |
转化关系 |
|
|
|
| |
物 质 | 甲 | FeCl2 | HCl | CaCO3 | CuSO4 |
乙 | Fe | H2O | CO2 | Cu | |
丙 | Fe2O3 | H2 | Na2CO3 | CuO | |
A.AB.BC.CD.D