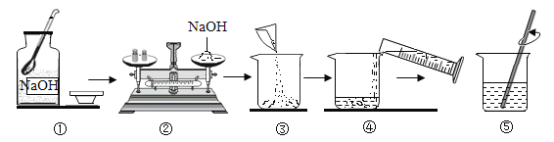
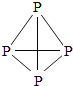题目内容
【题目】化学是一门以实验为基础的科学.做好化学实验是学好化学的基础。
Ⅰ.实验室用加热高锰酸钾固体制取氧气。
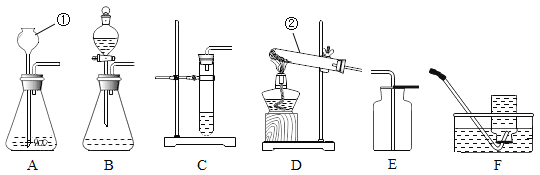
(1)A装置图中,仪器①的名称是__________。
(2)实验室用加热高锰酸钾固体制取并收集氧气所需的仪器是__________(选填下列装置图编号)。
(3)实验室制取并收集二氧化碳所需的仪器是___________(选填下列装置图编号),其反应的化学方程式________。
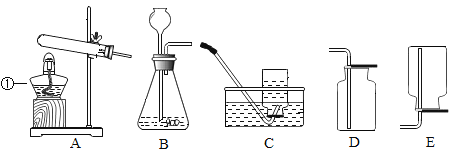
Ⅱ.科学严谨的态度,安全规范的操作是成功进行化学实验的保障。化学实验安全第一,下列实验要特别注意安全的是______________(填序号)。
A 取用大理石
B 称量粗盐
C 稀释浓硫酸
D 研碎胆矾
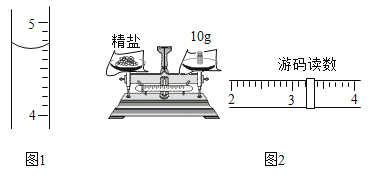
Ⅲ.根据下图1,读出液体的体积为_______mL;指出图2中游码最小刻度值为_______g;精盐质量是____g。
Ⅵ.实验室用下图所示的装置制取和收集某种气体,由装置可推知该气体的物理性质是_________,制取气体的反应一定是_________(填序号)。
A 不需要加热
B 需要催化剂
C 制取氧气的反应
D 反应物都是固体
【答案】酒精灯 AC或AD BD ![]() C 4.7 0.1 13.2 密度比空气的小 D
C 4.7 0.1 13.2 密度比空气的小 D
【解析】
(1)①为用于加热的酒精灯;
故答案为:酒精灯。
(2)反应物为固体,且需要加热,所以发生装置为A,氧气密度比空气大,可以向上排空法收集,不溶于水,可以排水法收集;
故答案为:AC或AD。
(3)反应物为固液混合物,不需要加热,所以选择B作为发生装置;二氧化碳密度比空气大,选择向上排空法收集,选择D;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,据此书写化学方程式;
故答案为:BD;![]() 。
。
Ⅱ、由于浓硫酸具有腐蚀性,稀释放出大量的热,因此稀释时要特别注意,因此选C;
故答案为:C。
Ⅲ、读取液体体积时,视线应与液体凹液面相平,液体凹液面在4和5mL之间,每个小格为0.1mL,所以此时读数为4.7mL;天平称量物品时应遵循左物右码的原则,游码2g到3g之间一共有10个分格,所以每一个分格为0.1g;此时精盐质量= 10g +3.2g=13.2g;
故答案为:4.7;0.1;13.2。
Ⅳ、集气瓶瓶口朝下,说明气体密度小于空气,发生装置为固体加热装置,所以反应物为固体:
A、有酒精灯,所以需要加热,选项A错误;
B、固体反应物不一定需要催化剂,选项B错误;
C、氧气密度比空气大,不能用向下排空气法收集,选项C错误;
D、反应装置的反应物一定是固体反应物,选项D正确;故选D;
故答案为:密度比空气的小;D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】19世纪50年代,白磷火柴在欧洲普遍流行。19 世纪末,人们发现利用白磷做火柴的工人,易患一种磷毒性颌骨坏死的疾病,至此白磷的毒性受到关注。各国也在不同时期宣布禁止生产和销售白磷火柴,于是火柴上的白磷渐渐被红磷取代。现代火柴头主要成分是氯酸钾和硫磺,火柴盒侧面的磷皮则使用了红磷,辅料包括石蜡、二氧化锰、炭黑、黏合剂和稳定剂等。
纯净的白磷是无色透明的晶体,遇光会逐渐变黄,因而又叫黄磷。白磷剧毒,误食0.1g就能致死。白磷接触皮肤也会引起吸收中毒。白磷不溶于水,易溶于二硫化碳。经测定,白磷的分子式为P4。白磷最特殊的性质就是能在潮湿的空气中发生缓慢氧化,反应产生的部分能量以光能的形式放出,故在暗处可看到白磷发光。当缓慢氧化积累的能量达到它的着火点(40° C)时便发生自燃,因此白磷通常储存在水中。
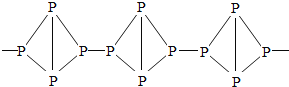
白磷和红磷虽然一字之差,但是它们的结构、着火点和毒性却有很大不同。白磷有剧毒、着火点低、是四面体型分子,而红磷无毒、着火点较高,是链状分子。
物质性质 | 白磷 | 红磷 |
毒性 | 剧毒 | 无毒 |
着火点 | 40 °C | 240 °C |
分子结构 |
|
|
依据上文,回答下列问题:
(1)白磷的物理性质_________(任写一条)。
(2)白磷燃烧反应的化学方程式为__________。
(3)现代火柴摩擦生火时燃烧的物质中,除木棍外还有_______。
(4)白磷通常保存在水中,而不放置在空气中的原因是_________。
(5)白磷与红磷性质不同的主要原因是________。
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
Ⅰ.(镍粉制备):
工业用电解镍新液(主要含NiSO4、NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],并利用其制备镍粉的流程如下:
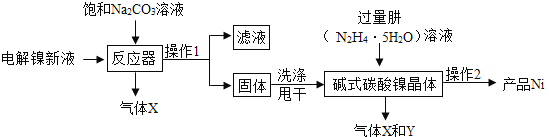
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2CO2↑,生成的气体直接排放对环境的影响是___________。
(2)物料在反应器中反应时需要控制反应条件。
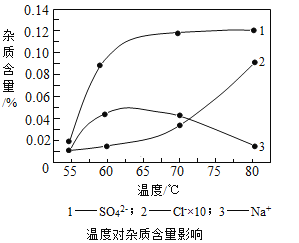
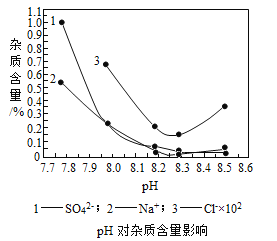
分析上图,反应器中最适合的温度及pH分别为__________、8.3。
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将_____________(填“升高”、“降低”或“不变”)。
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作。其中使用95%酒精浸泡的目的是_________
Ⅱ.(测定碱式碳酸镍晶体的组成):
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如下实验方案及装置:
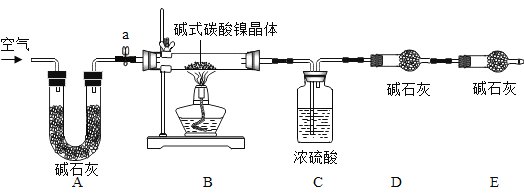
(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称取7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 252.16 | 190.88 | 190.00 |
(实验分析及数据处理)
(5)实验过程中步骤③鼓入空气的目的是__________。装置A的作用是______。
(6)计算7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]完全分解中镍元素的质量__。最终通过计算得到了碱式碳酸镍晶体的组成,x:y:z=_______
(实验反思)
(7)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显偏大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会部分被氧化成Ni2O3。 该组同学称得的残留固体混合物的质量可能是_____________。
A 4.5g B 4.6g C 4.98g D 5.2g