题目内容
【题目】有一瓶红色粉末,由铜和氧化铁中的一种或两种组成。某化学兴趣小组对该红色粉末的组成进行了探究。
(设计实验)实验装置如图,实验步骤如下:
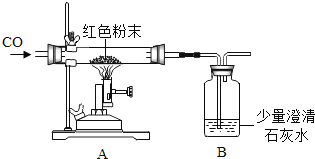
(1)连接好装置并检查气密性。
(2)装入药品,通入一段时间一氧化碳。
(3)继续缓缓通入一氧化碳,点燃酒精喷灯,使反应充分进行。
(4)完全反应后熄灭酒精喷灯,继续通入一氧化碳至恢复到室温。
(讨论交流)
(1)反应前通入一段时间一氧化碳的目的是__________________________________。
(2)甲同学提出,为了防止溶液倒吸,熄灭酒精喷灯前应先断开装置A和B的连接,你认为是否需要并说明理由:______________________。
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,点燃前应对气体_____________。
(进行实验)该小组同学按上述步骤进行实验,观察到以下现象,确定该红色粉末由铜和氧化铁组成。
(1)硬质玻璃管中出现黑色物质,对应的化学方程式为_______________________。
(2)澄清石灰水变浑浊,对应的化学方程式为_______________________。
(3)完全反应后硬质玻璃管中仍有红色固体剩余。
(定量分析)上述实验中,测得某些实验数据如下表。请通过计算进一步确定该红色粉末中各成分的质量比:_____________________________。
反应前 | 红色粉末的质量 | 8.0g |
硬质玻璃管的质量 | 64.6g | |
反应后 | 硬质玻璃管和其中固体的总质量 | 70.8g |
(拓展探究)将上述实验反应后硬质玻璃管中的固体研磨成粉末。
(1)取少量粉末于小烧杯中,向其中加入足量稀盐酸,充分反应,你能观察到的现象有:__________________________。
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,充分反应后过滤。向滤渣中滴加稀盐酸,有气泡产生,则滤渣为_________(写化学式,下同),滤液中的溶质为_________。
【答案】排出装置中的空气,防止一氧化碳混有一定量的空气,高温时爆炸 不需要,因为熄灭酒精喷灯后还要继续通入一氧化碳至恢复到室温 验纯 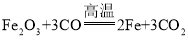
![]() 铜和氧化铁的质量比为1∶3 产生无色气体,溶液变为浅绿色,有红色固体残留 Fe、Cu、Ag Fe(NO3)2
铜和氧化铁的质量比为1∶3 产生无色气体,溶液变为浅绿色,有红色固体残留 Fe、Cu、Ag Fe(NO3)2
【解析】
讨论交流:
(1)反应前通入一段时间一氧化碳的目的是:一氧化碳具有可燃性,可燃性气体混有一定量的空气,遇明火容易发生爆炸,故先通入一段时间一氧化碳,将装置内的空气排尽,防止发生爆炸;
(2)不需要,因为熄灭酒精喷灯后,还要继续通一段时间一氧化碳至恢复至室温;
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,一氧化碳具有可燃性,混有一定量的空气,遇明火容易发生爆炸,故点燃前应对气体验纯;
进行实验:
(1)硬质玻璃管中出现黑色物质,是因为氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为: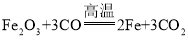 ;
;
(2)澄清石灰水变浑浊是因为氢氧化钙与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;
;
定量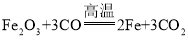 ,反应后,装置内减少的质量为氧化铁中氧元素的质量,氧元素的质量为:64.6g+8.0g-70.8g=1.8g,红色粉末中氧化铁的质量为:
,反应后,装置内减少的质量为氧化铁中氧元素的质量,氧元素的质量为:64.6g+8.0g-70.8g=1.8g,红色粉末中氧化铁的质量为:![]() ,红色粉末中铜的质量为:8.0g-6g=2g,故红色粉末中铜和氧化铁的质量比为:2g:6g=1:3;
,红色粉末中铜的质量为:8.0g-6g=2g,故红色粉末中铜和氧化铁的质量比为:2g:6g=1:3;
拓展研究:
(1)将上述实验反应后硬质玻璃管中的固体研磨成粉末,取少量粉末于烧杯中,加入足量稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,故实验现象为:有气泡生成,溶液变为浅绿色,有红色固体残留;
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,铁先与硝酸银反应生成硝酸亚铁和银,待铁完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,说明铁过量,硝酸银已经完全被置换,铜未参与反应,故滤渣为:Fe、Cu、Ag;
铁过量,说明只有铁和硝酸银发生了反应生成了硝酸亚铁和银,且硝酸银已经完全反应,故滤液中的溶质为:Fe(NO3)2。

 阅读快车系列答案
阅读快车系列答案