题目内容
【题目】燃烧是人类最早利用的化学反应之一。
(1)通常情况下,可燃物与氧气发生的一种_______________的剧烈的氧化反应叫做燃烧。燃烧需要三个条件:①可燃物,②氧气(或空气),③_______________。
(2)二氧化碳能用于灭火。实验室常用大理石与稀盐酸反应制取二氧化碳,该反应的化学方程式为___________________。
(3)氢气被认为是理想的清洁、高能燃料。电解水可以制取氢气,该反应的化学方程式为______________。作为化学电源,氢氧燃料电池已经被应用,如用作汽车的驱动电源等,氢氧燃料电池工作时,把化学能直接转变为_________能。
【答案】发光、放热 达到燃烧所需的最低温度(或温度达到着火点) ![]()
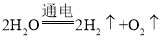 电
电
【解析】
(1)通常情况下,可燃物与氧气发生的一种发光、放热的剧烈的氧化反应叫做燃烧;
燃烧需要三个条件:①可燃物,②氧气(或空气),③达到燃烧所需的最低温度(也叫着火点);
(2)实验室常用大理石与稀盐酸反应制取二氧化碳,该反应的化学方程式为:![]() ;
;
(3)水在通电的条件下分解为氢气和氧气,该反应的化学方程式为: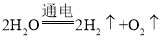 ;
;
氢氧燃料电池工作时,把化学能直接转变为电能。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】(1)小琪等几位同学准备进行鉴别澄清石灰水和氢氧化钠溶液的实验探究,请你参与:
(提出问题)如何鉴别这两种无色溶液?
(实验方案)他们进行了如图所示的实验

请你回答下列问题:
①四组实验中不能达到实验目的是___________(填字母);
②C组实验中反应的化学方程式为________________________;
③D组实验中变浑浊的原溶液是_______________。
(继续探究)实验结束后,小琪同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
(提出问题)该溶液中除水、酚酞外还含有哪些物质?
(查阅资料)氯化钙溶液呈中性.
(猜想与假设)
Ⅰ._______________
Ⅱ.NaCl、CaCl2、HCl
Ⅲ.NaCl、CaCl2、NaOH
(反思与拓展)①上述猜想与假设中只有一个不成立,它是_____(填序号),理由是________。
②根据所学化学知识,验证烧杯内溶液中可能有的物质是否存在,下列哪些物质单独使用不能完成该实验___________(填字母)
a pH试纸 b 硝酸银溶液 c 紫色石蕊试液 d 铜 e 足量氢氧化钠溶液.
(2)葡萄糖是生命体所需能量的主要来源。
(提出问题)葡萄糖的燃烧产物是CO2和H2O,由此能否证明葡萄糖是只由碳元素和氢元素组成的有机物?
(设计实验)为了确定葡萄糖的元素组成,某小组设计了如下实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。
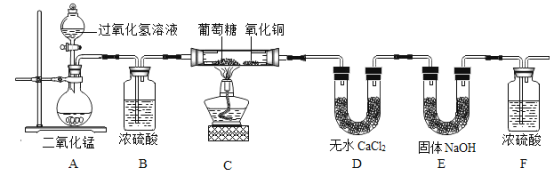
①装置A中发生反应的化学方程式是__________________________;
②装置B中浓硫酸的作用是_________________________。
③装置C处氧化铜的作用是_________________________。
(方案评价)
①用充有空气的储气球代替装置A,是否更有利于实验的进行?_____(填“是”或“否”)原因是______________________。
②装置C处葡萄糖燃烧的设计特点是_________________(至少一条)。
(数据处理)下表是同学们填写的实验报告,请你帮助完成。
实验事实 | 数据分析及结论 |
1.8g葡萄糖完全燃烧,得到2.64gCO2和1.08gH2O | 数据___________________________ 结论:葡萄糖含有C、H、O三种元素 |
(讨论交流)为了尽量减少误差:
(1)该实验在进行过程中应注意的问题是_______________(1条)。
(2)从定量实验的角度看,该实验可进一步改进。请简要写出一个改进意见:________。
【题目】有一瓶红色粉末,由铜和氧化铁中的一种或两种组成。某化学兴趣小组对该红色粉末的组成进行了探究。
(设计实验)实验装置如图,实验步骤如下:
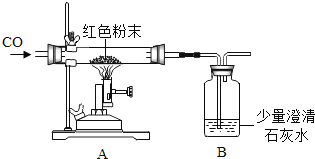
(1)连接好装置并检查气密性。
(2)装入药品,通入一段时间一氧化碳。
(3)继续缓缓通入一氧化碳,点燃酒精喷灯,使反应充分进行。
(4)完全反应后熄灭酒精喷灯,继续通入一氧化碳至恢复到室温。
(讨论交流)
(1)反应前通入一段时间一氧化碳的目的是__________________________________。
(2)甲同学提出,为了防止溶液倒吸,熄灭酒精喷灯前应先断开装置A和B的连接,你认为是否需要并说明理由:______________________。
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,点燃前应对气体_____________。
(进行实验)该小组同学按上述步骤进行实验,观察到以下现象,确定该红色粉末由铜和氧化铁组成。
(1)硬质玻璃管中出现黑色物质,对应的化学方程式为_______________________。
(2)澄清石灰水变浑浊,对应的化学方程式为_______________________。
(3)完全反应后硬质玻璃管中仍有红色固体剩余。
(定量分析)上述实验中,测得某些实验数据如下表。请通过计算进一步确定该红色粉末中各成分的质量比:_____________________________。
反应前 | 红色粉末的质量 | 8.0g |
硬质玻璃管的质量 | 64.6g | |
反应后 | 硬质玻璃管和其中固体的总质量 | 70.8g |
(拓展探究)将上述实验反应后硬质玻璃管中的固体研磨成粉末。
(1)取少量粉末于小烧杯中,向其中加入足量稀盐酸,充分反应,你能观察到的现象有:__________________________。
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,充分反应后过滤。向滤渣中滴加稀盐酸,有气泡产生,则滤渣为_________(写化学式,下同),滤液中的溶质为_________。