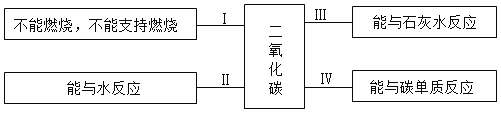
题目内容
【题目】下列图像正确反映实验变化关系的是( )
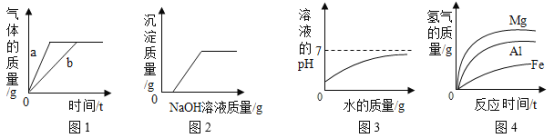
A.图1:用等体积5%过氧化氢溶液制O2,其中a未使用催化剂,b使用了催化剂
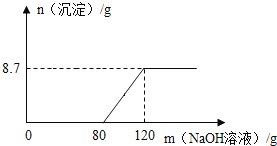
B.图2:向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
C.图3:向氢氧化钠溶液中滴加足量的水
D.图4:将等质量的不同金属分别放到足量的相同稀盐酸中
【答案】B
【解析】
A、催化剂能加快过氧化氢分解的速率,可以缩短反应时间,即a的反应时间应长一点,b的反应时间短,选项错误;
B、向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液,氢氧化钠先与硫酸发生中和反应,然后才与硫酸铜反应生成沉淀氢氧化铜,直至硫酸铜完全反应沉淀的质量不再增加,选项正确;
C、向氢氧化钠溶液中滴加足量的水,溶液的碱性减小,但溶液始终呈碱性,即溶液的pH逐渐接近7,但始终大于7,选项错误;
D、等质量的镁、铝、铁与足量酸反应后生成的氢气的质量由大到小的关系为铝>镁>铁,选项错误,故选B。

【题目】有一瓶红色粉末,由铜和氧化铁中的一种或两种组成。某化学兴趣小组对该红色粉末的组成进行了探究。
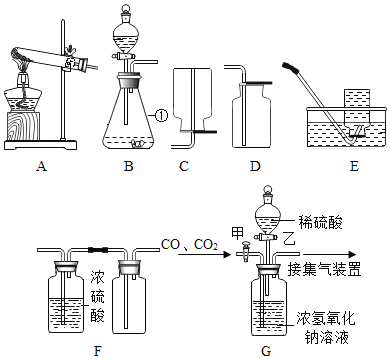
(设计实验)实验装置如图,实验步骤如下:
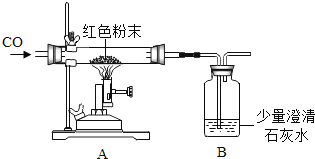
(1)连接好装置并检查气密性。
(2)装入药品,通入一段时间一氧化碳。
(3)继续缓缓通入一氧化碳,点燃酒精喷灯,使反应充分进行。
(4)完全反应后熄灭酒精喷灯,继续通入一氧化碳至恢复到室温。
(讨论交流)
(1)反应前通入一段时间一氧化碳的目的是__________________________________。
(2)甲同学提出,为了防止溶液倒吸,熄灭酒精喷灯前应先断开装置A和B的连接,你认为是否需要并说明理由:______________________。
(3)经过讨论,该小组同学认为,装置B后还需添加一个酒精灯,并在实验步骤(2)中点燃,点燃前应对气体_____________。
(进行实验)该小组同学按上述步骤进行实验,观察到以下现象,确定该红色粉末由铜和氧化铁组成。
(1)硬质玻璃管中出现黑色物质,对应的化学方程式为_______________________。
(2)澄清石灰水变浑浊,对应的化学方程式为_______________________。
(3)完全反应后硬质玻璃管中仍有红色固体剩余。
(定量分析)上述实验中,测得某些实验数据如下表。请通过计算进一步确定该红色粉末中各成分的质量比:_____________________________。
反应前 | 红色粉末的质量 | 8.0g |
硬质玻璃管的质量 | 64.6g | |
反应后 | 硬质玻璃管和其中固体的总质量 | 70.8g |
(拓展探究)将上述实验反应后硬质玻璃管中的固体研磨成粉末。
(1)取少量粉末于小烧杯中,向其中加入足量稀盐酸,充分反应,你能观察到的现象有:__________________________。
(2)再取少量粉末于另一个小烧杯中,向其中加入一定量硝酸银溶液,充分反应后过滤。向滤渣中滴加稀盐酸,有气泡产生,则滤渣为_________(写化学式,下同),滤液中的溶质为_________。