题目内容
(3分)化学小组同学欲测定某NaCl和Na2SO4固体混合物中NaCl的质量分数,其实验操作及所得数据如下:将一定质量的该固体混合物完全溶于100g水中,加入一定溶质质量分数的BaCl2溶液117g恰好完全反应,过滤,得到23.3g沉淀和溶质质量分数为10%的滤液。请计算: 原固体混合物中NaCl的质量分数。(最后结果保留1位小数)
(已知:Na2SO4 + BaCl2= BaSO4↓+ 2NaCl)
(已知:Na2SO4 + BaCl2= BaSO4↓+ 2NaCl)
41.6%
根据题目信息可知,白色沉淀是硫酸钡,然后写出化学方程式并代入数据计算出硫酸钠的质量
[解]设:原混合物中硫酸钠的质量为x,生成氯化钠的质量为y
 Na2SO4 + BaCl2 BaSO4↓ + 2NaCl
Na2SO4 + BaCl2 BaSO4↓ + 2NaCl
142 233 117
x 23.3g y
x="14.2g" y=11.7g ……………………………(1分)
设原混合物中氯化钠的质量为z
z = 10.1g ……………………………(1分)
原混合物中氯化钠的质量分数=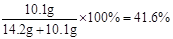 ………(1分)
………(1分)
答:原混合物中氯化钠的质量分数为41.6%。
[解]设:原混合物中硫酸钠的质量为x,生成氯化钠的质量为y
 Na2SO4 + BaCl2 BaSO4↓ + 2NaCl
Na2SO4 + BaCl2 BaSO4↓ + 2NaCl142 233 117
x 23.3g y
x="14.2g" y=11.7g ……………………………(1分)
设原混合物中氯化钠的质量为z
z = 10.1g ……………………………(1分)
原混合物中氯化钠的质量分数=
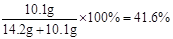 ………(1分)
………(1分)答:原混合物中氯化钠的质量分数为41.6%。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目