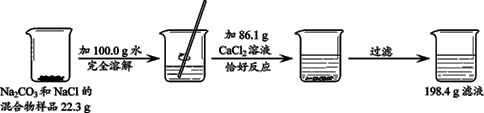题目内容
(5分)现有12.2g碳酸钠和氯化钠的混合物与一定质量溶质质量分数为7.3%的盐酸恰好完全反应,生成二氧化碳2.2g(二氧化碳气体全部逸出)。
求:(1)原混合物中碳酸钠的质量
(2)反应后所得溶液中溶质的质量分数
求:(1)原混合物中碳酸钠的质量
(2)反应后所得溶液中溶质的质量分数
(1)5.3g(2分)
(2)21.25%(算出盐酸溶液质量1分,氯化钠质量1分,溶质质量分数1分)
(2)21.25%(算出盐酸溶液质量1分,氯化钠质量1分,溶质质量分数1分)
:(1)根据题意可以知道生成二氧化碳气体的质量为2.2g,可以据此计算.
设碳酸钠的质量为x,反应生成的氯化钠质量为y,稀盐酸的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z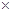 7.3% y 2.2g
7.3% y 2.2g
解得:x=5.3g,y=5.85g;z=50g
(2)最后得到的溶液中溶质质量为:(12.2g-5.3g)+5.85g=12.75g;
最后得到的溶液的质量为:12.2g+50g-2.2g=60g;
最后得到的溶液中溶质质量分数为: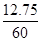 ×100%=21.25%
×100%=21.25%
设碳酸钠的质量为x,反应生成的氯化钠质量为y,稀盐酸的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z
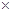 7.3% y 2.2g
7.3% y 2.2g解得:x=5.3g,y=5.85g;z=50g
(2)最后得到的溶液中溶质质量为:(12.2g-5.3g)+5.85g=12.75g;
最后得到的溶液的质量为:12.2g+50g-2.2g=60g;
最后得到的溶液中溶质质量分数为:
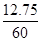 ×100%=21.25%
×100%=21.25%
练习册系列答案
相关题目
 CaO + CO2 ↑。
CaO + CO2 ↑。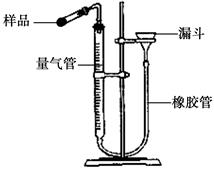
 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。