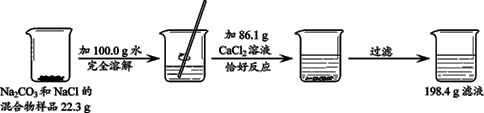题目内容
氢化钙(CaH2)是一种重要的制氢剂,与水接触时,发生反应生成氢氧化钙和氢气。
小题1:写出该反应的化学方程式。
小题2:若需要40 g氢气,计算至少需要消耗氢化钙的质量。
小题1:写出该反应的化学方程式。
小题2:若需要40 g氢气,计算至少需要消耗氢化钙的质量。
小题1:CaH2 + 2H2O=Ca(OH)2 + 2H2↑
小题2:420g
可根据氢气的质量,利用化学方程式,列出比例式,求出氢化钙的质量,进行解答
【解】设:至少需要消耗氢化钙的质量为x。
CaH2 + 2H2O=Ca(OH)2 + 2H2↑
42 4
x 40 g
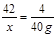
x =" 420" g
【解】设:至少需要消耗氢化钙的质量为x。
CaH2 + 2H2O=Ca(OH)2 + 2H2↑
42 4
x 40 g
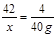
x =" 420" g

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
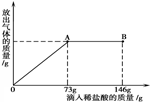
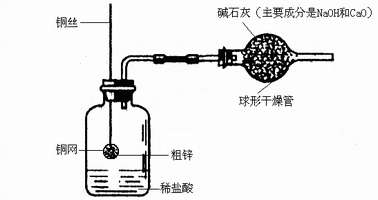
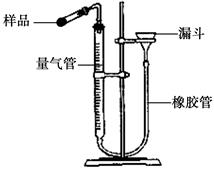
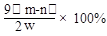 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。