题目内容
由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。该混合物10g,将其投入适量的稀硫酸中恰好完全反应,所得溶液中溶质的质量为
| A.12g | B.24g | C.36g | D.48g |
B
因Mg(OH)2+H2SO4═MgSO4+2H2O,MgO+ H2SO4═MgSO4+H2O,
混合物恰好完全反应,则混合物中镁元素的质量等于MgSO4中镁元素的质量,
设反应后溶液中的溶质MgSO4的质量为xg,则
Mg~MgSO4
24 120
10g×48% xg
24/120 =10g×48%/xg解得x=24g
故选B.
混合物恰好完全反应,则混合物中镁元素的质量等于MgSO4中镁元素的质量,
设反应后溶液中的溶质MgSO4的质量为xg,则
Mg~MgSO4
24 120
10g×48% xg
24/120 =10g×48%/xg解得x=24g
故选B.

练习册系列答案
相关题目
 CaO + CO2 ↑。
CaO + CO2 ↑。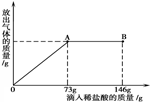
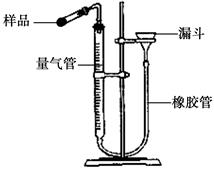
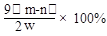 。此方案测定结果偏小的原因可能是 。
。此方案测定结果偏小的原因可能是 。