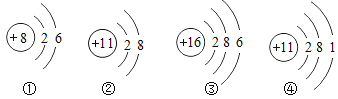题目内容
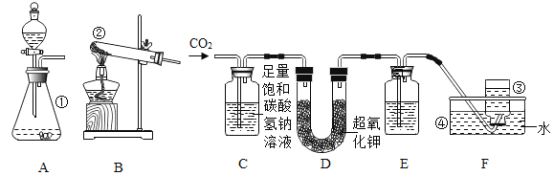
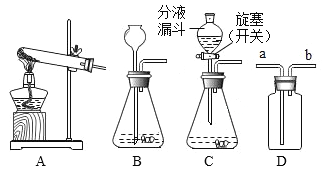
【题目】化学活动小组的同学欲探究盐的化学性质,进行了如下图所示的实验:
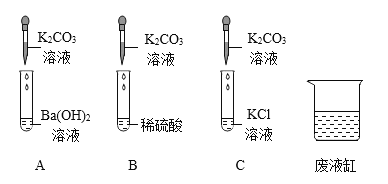
(观察与记录)
A 试管中的现象是_______________________;B 试管中发生反应的化学方程式是___________; 实验后,同学们将 C、B、A 三支试管中的物质依次都倒入同一个废液缸中,整个过程只观察到固体增多,无其他明显现象。通过此现象,小明画出向 A 试管加入碳酸钾溶液整个过程所得溶液中离子变化情况的图像,结合图像你认为下列两个选项相对合理的是 _________
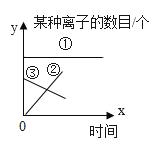
a、①为OH- ②为K+③为Ba2+
b、①为OH-②为CO32-③为Ba2+
为了更好的处理废液,同学们对废液中最终的离子成分展开探究。
(提出问题)最终废液中的离子成分?
(猜想与假设)甲同学猜想:K+、Cl-、OH-;
乙同学猜想:K+、Cl-、OH-、CO32-;
丙同学猜想:K+、Cl-、OH-、CO32-、SO42-;
你的猜想:_____;(填一种情况)
(实验与交流)乙同学为证明自己的猜想,取样于试管中,向其中加入足量的稀盐酸,观察到有气泡产生,于是得出自己的猜想是正确的。大家经过讨论认为还可能是___________ 同学的猜想;为了得出最终结论,同学们又向乙同学的实验后的废液中加入_____,没有观察到明显现象,于是得出了乙同学的猜想符 合事实。
(反思与总结)通过上述探究过程我们可以总结出:要想确定混合溶液中离子成分的可能情况,可以先通过有目的的控制_____,并结合观察到的具体现 象进行分析。然后再进行进一步的探究就比较容易得出正确结论。
【答案】(无色)溶液中有白色沉淀生成; K2CO3+H2SO4==K2SO4+CO2↑+H2O a K+、Cl—、OH—、SO42— 丙 硝酸钡溶液或氯化钡溶液或氢氧化钡溶液 溶液倾倒的顺序
【解析】
[观察记录]
A中碳酸钾与氢氧化钡反应生成碳酸钡沉淀和氢氧化钾,可以看到白色沉淀;
B中硫酸与碳酸钾反应生成硫酸钾、二氧化碳和水,化学方程式K2CO3+H2SO4==K2SO4+CO2↑+H2O;
将 C、B、A 三支试管中的物质依次都倒入同一个废液缸中,整个过程只观察到固体增多,无其他明显现象。说明酸没有剩余,氢氧化钡过量,所以A中溶质为氢氧化钡和氢氧化钾,此时加入碳酸钾,碳酸钾与氢氧化钡继续反应生成碳酸钡沉淀和氢氧化钾,反应过程没有消耗氢氧根,所以反应前后没有改变,所以①为氢氧根离子,离子减少的为钡离子,所以③为钡离子,加入碳酸钾后钾离子数目增多,因此②为钾离子,故选a;
[猜想与假设]
反应生成的氯化钾,没有被消耗,所以一直在溶液中,由于酸已经被消耗完毕,生成了硫酸钾,所以硫酸钾是否全部生成沉淀无法判断,另外碳酸钾也无法判断是否生成了碳酸钡沉淀,所以溶质一定存在氯化钾和氢氧化钾,但是硫酸钾和碳酸钾无法判断,因此一定存在离子为钾离子、氯离子、氢氧根离子,而碳酸根和硫酸根是否存在不能断定,因此进行猜想;故猜想为:K+、Cl-、OH-、SO42-。
[实验与交流]
验证乙同学猜想需要验证碳酸根和硫酸根是否存在,加入盐酸生成二氧化碳,可以看到气泡,因此可以推断含有碳酸根,但是丙同学猜想同样含有碳酸根,也会出现相同现象,因此需要判断硫酸根是否存在,因此在加入足量盐酸后,碳酸根被消耗完毕,此时硫酸根与钡离子可以生成沉淀,所以加入含有钡离子的可溶性试剂即可,氯化钡溶液或者硝酸钡溶液或者氢氧化钡溶液,观察是否有沉淀,判断硫酸根是否存在,从而得出猜想的正确性;
[反思与总结]
在通过C、B、A的顺序加入反应后的物质,通过没有气泡判断出不含有硫酸,因此可以通过控制加入反应物的顺序,得出是否含有某些离子;

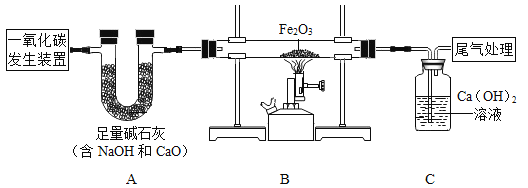
【题目】下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
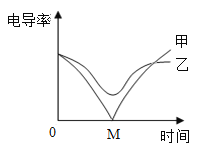
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应