题目内容
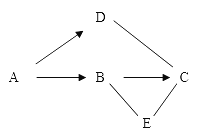
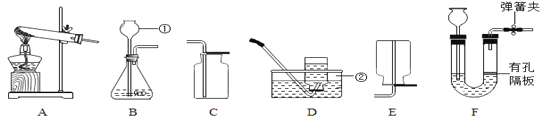
【题目】如图是实验室制取气体的常用装置。
(1)请写出一个用图中装置制取氧气的化学方程式____。
(2)D装置是一储气瓶,若要用该储气瓶中的氧气,应从____(填“a”或“b”)端向储气瓶中注入水。
【答案】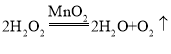 (或
(或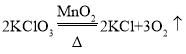 或
或![]() ) a
) a
【解析】
(1)实验室可采用分解过氧化氢溶液(选用装置B)、加热氯酸钾或高锰酸钾(选用装置A)的方法制取氧气,采用分解过氧化氢溶液的方法,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为: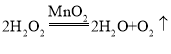 ;采用加热氯酸钾(二氧化锰作催化剂)的方法,加热条件下,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:
;采用加热氯酸钾(二氧化锰作催化剂)的方法,加热条件下,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为: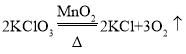 ;采用加热高锰酸钾的方法,加热条件下,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:
;采用加热高锰酸钾的方法,加热条件下,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:![]() 。
。
(2)D装置是一储气瓶,若要用该储气瓶中的氧气,应从a端向储气瓶中注入水,将氧气从b端排出。

【题目】某学习小组对碳酸钠、碳酸氢钠和稀盐酸的反应进行了探究。
(1)分别在盛有少量碳酸钠(俗称________)、碳酸氢钠固体的试管中加入足量稀盐酸,观察到都剧烈反应且产生大量气泡。碳酸氢钠和稀盐酸反应的化学方程式为_______。
(提出问题)
碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?
(设计与实验)
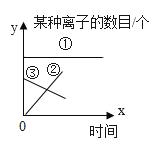
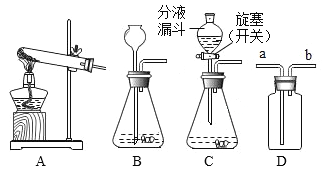
(2)甲设计的实验如图1所示,实验时,两注射器中的稀盐酸应________(填操作),观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。

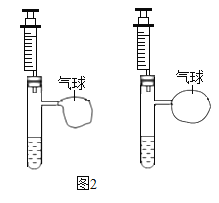
(3)乙对甲的实验提出了质疑:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过观察很难判断产生气体的快慢;
②当稀盐酸足量时,相同质量的固体,___________与稀盐酸反应生成的二氧化碳更多;他认为,应取含碳元素质量相同的碳酸钠和碳酸氢钠分别与稀盐酸反应。
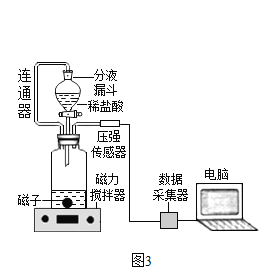
(4)小组同学在老师指导下设计了图3所示的实验。
分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液,以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,广口瓶内压强随时间变化如图4所示。
(实验结论)
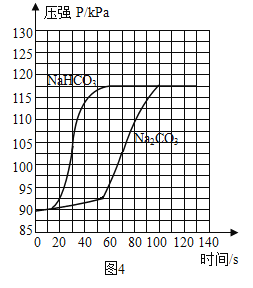
(5)分析图4所示的实验数据可得到的结论是:相同条件下,_________和稀盐酸反应产生二氧化碳较快,理由是__________。
(反思与应用)
(6)小组同学查阅资料分析实验现象和图4数据,得出碳酸钠和稀盐酸反应产生二氧化碳较慢的原因是:碳酸钠先与稀盐酸反应生成碳酸氢钠和氯化钠,反应生成的碳酸氢钠再与稀盐酸反应。
(7)通过以上探究与分析,小组同学设计了只用试管和胶头滴管鉴別碳酸钠溶液和稀盐酸的实验。
操作 | 现象与结论 |
未知溶液分別编号为a、b,取适量a于试管中,用胶头滴管逐滴滴入b并振荡 | ①若刚开始无明显现象,后随着b不断滴入产生较多气泡,则b是________; ②若立即产生大量气泡,则b是_______。 |
【题目】实验小组将澄清石灰水和碳酸钠溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
[猜想与假设]①含有NaOH;
②含有____.
③含有NaOH、Na2CO3;
④含有 NaOH、Na2CO3和Ca(OH)2。
[设计与实验]
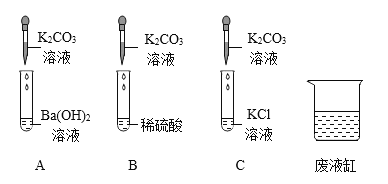
(1)大家认为猜想_____一定不正确,其原因是_______。
(2)甲同学取滤液M样品,向其中加入足量的____,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下
实验操作 | 现象 | 结论 |
取一定量滤液M于试管中,加入__溶液 | ________ | 猜想②成立 |
相关反应的化学方程式为____。
[交流与反思]若将滤液M直接倒入下水道,对环境造成的影响是会污染水源。
(4)若假设①成立,取反应后的滤液M 100克,加入10克溶质质量分数为3. 65%的稀盐酸恰好完全反应,则滤液中溶质的质量分数是多少____?