ΧβΡΩΡΎ»ί
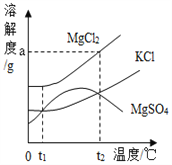
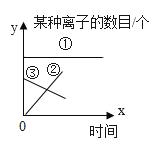
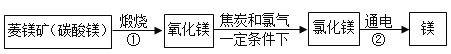
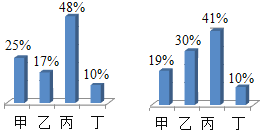
ΓΨΧβΡΩΓΩ ΓΑ“ΒΨΪ”Ύ«ΎΘ§ΜΡ”Ύφ“ΘΜ––≥…”ΎΥΦΘ§ΜΌ”ΎΥφΓΘΓ±”»ΤδΆχ ΩΈΤΎΦδΘ§Ή‘¬…–‘”»ΈΣ÷Ί“ΣΘΓΚήΕύΆ§―ßΟ«‘Ύ’βΕΈΧΊ β ±ΤΎ±μœ÷≥ω ά¥ΒΡΉ‘¬…Χ§Ε»ΚΆ«ΎΖήΨΪ…ώ»Οάœ ΠΟ«Ζ«≥ΘΗ–Ε·ΚΆ«’≈εΘΓΒΪ”…”Ύ ≥Λ ±ΦδΒΡ”Π”ΟΒγΉ”≤ζΤΖΘ§Ε‘Έ“Ο«ΒΡ ”ΝΠ‘λ≥…ΝΥ“ΜΕ®ΒΡ”ΑœλΓΘ “ρ¥ΥΘ§Έ“Ο«“Σ”–“β ΕΒΡ±ΘΜΛ―έΨΠΓΘ±»»γΘΚ–¥Ής“Β ±Θ§Έ“Ο«ΨΆ“Σ”ΟΚΟ“ΜΒψΒΡΜΛ―έΒΤΓΘ«κΆ§―ßΟ«ΫΪΜΛ―έΒΤ…φΦΑΒΫΒΡ±ξ”––ρΚ≈ΒΡΝψΦΰ―Γ≥ωΫπ τ≤ΡΝœΓΘ τ”ΎΫπ τ≤ΡΝœ”–_______________ΘΜΜΛ―έΒΤΥυ”ΟΒγœΏΆβΤΛ « _______________Θ®ΧνΥθ–¥¥ζΚ≈Θ©ΜΛ―έΒΤΥυ”ΟΒΡ¬ΝΒΞ÷ ΒΡ“±ΝΕΘ§ΉνΚσ“Μ≤Ϋ‘≠άμ «‘Ύ―θΜ·¬Ν÷–Φ”»κ±υΨß ·Θ§‘ΎΆ®ΒγΒΡΧθΦΰœ¬≤ζ…ζΝΫ÷÷ΒΞ÷ ΓΘΆ§―ßΟ« ‘Ή≈–¥≥ωΗΟ‘≠άμΒΡΖΫ≥Χ ΫΘΚ______________ΘΜΜ·―ß±δΜ·÷–Φ»”–Έο÷ ÷÷άύΒΡ±δΜ·Θ§“≤ ΑιΥφΉ≈ΡήΝΩΒΡΗΡ±δΘ§‘ΎΗΟ±δΜ·÷– Βœ÷ΝΥ______________Ρήœρ_______________ΡήΒΡΉΣΜ·Ιΐ≥ΧΓΘ
ΓΨ¥πΑΗΓΩΔΌΔΎΔή PVC 2Al2O3![]() 4Al+3O2Γϋ ΒγΡή Μ·―ßΡή
4Al+3O2Γϋ ΒγΡή Μ·―ßΡή
ΓΨΫβΈωΓΩ
Ϋπ τ≤ΡΝœΑϋά®¥ΩΫπ τ“‘ΦΑΚœΫπΘ§Ι Χζ¬ίΥΩΕΛΓΔ¬Ν≤≠Ζ¥ΙβΤ§ΓΔΆ≠÷Τ≤εΆΖΕΦ τ”ΎΫπ τ≤ΡΝœΘΜΒγœΏΆβΤΛ «Ψέ¬»““œ©Θ§¥ζΚ≈ΈΣPVCΘΜ‘Ύ―θΜ·¬Ν÷–Φ”»κ±υΨß ·Θ§‘ΎΆ®ΒγΒΡΧθΦΰœ¬≤ζ…ζΝΫ÷÷ΒΞ÷ ΈΣ¬ΝΚΆ―θΤχΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣ2Al2O3![]() 4Al+3O2ΓϋΘΜΒγΫβΙΐ≥Χ÷–ΒγΡήΉΣΜ·ΈΣΜ·―ßΡήΓΘ
4Al+3O2ΓϋΘΜΒγΫβΙΐ≥Χ÷–ΒγΡήΉΣΜ·ΈΣΜ·―ßΡήΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
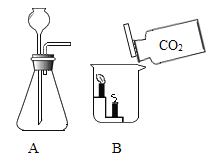
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ«κ¥”1Μρ2ΝΫΧβ÷–»Έ―Γ1ΗωΉς¥πΓΘ
O2ΒΡ Β―ι “÷Τ»Γ”κ–‘÷ | CO2ΒΡ Β―ι “÷Τ»Γ”κ–‘÷ |
Θ®1Θ©A÷–Φ”»»ΗΏΟΧΥαΦΊΘ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___________ΓΘ Θ®2Θ©B÷–Ω…Ιέ≤λΒΫΒΡœ÷œσ «__________ΓΘ |
Θ®1Θ©A÷–œρ¥σάμ ·÷–Φ”»κœΓ―ΈΥαΘ§ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ__________ΓΘ Θ®2Θ©B÷–Ω…Ιέ≤λΒΫΒΡœ÷œσ «__________ΓΘ |
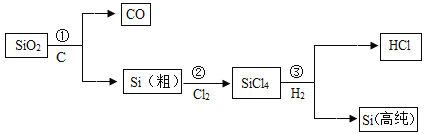
ΓΨΧβΡΩΓΩΈ“ΙζΡ≥ΩΤ―–Ά≈Ε”“‘»μΟΧΩσΘ®÷ς“Σ≥…Ζ÷ «MnO2Θ§Κ§”–SiO2ΓΔFe2O3Β»…ΌΝΩ‘”÷ Θ©ΈΣ÷ς“Σ‘≠ΝœΘ§÷Τ»ΓΗΏ¥ΩΧΦΥαΟΧΘ§ΙΛ“’Νς≥Χ»γœ¬ΆΦ:
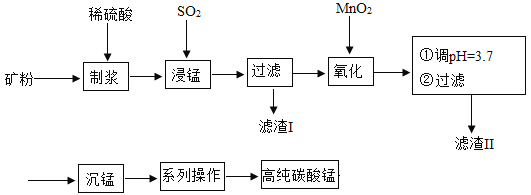
“―÷ΣΘΚΔΌSiO2≤Μ»ή”ΎΥ°Θ§≤Μ”κœΓH2SO4ΓΔSO2Ζ¥”ΠΘΜΔΎMnO2ΡήΫΪFe2+―θΜ·≥…Fe3+ΘΜΔέ»ή“Κ÷–ΒΡFe3+‘Ύ pH ¥σ”ΎΜρΒ»”Ύ 3.2 ±ΫΪΆξ»ΪΉΣΜ·ΈΣFe(OH)3≥ΝΒμΓΘ
«κΜΊ¥πΘΚΘ®1Θ©¬Υ‘ϋΔώΓΔΔρΖ÷±πΈΣ_____ΓΔ_____Θ®–¥Μ·―ß ΫΘ© ΘΜ
Θ®2Θ©ΫΰΟΧΙΐ≥Χ÷–ΖΔ…ζΝΥ 2 ΗωΜ·―ßΖ¥”ΠΘ§Τδ÷–“ΜΗωΈΣFe2O3”κSO2Ζ¥”ΠΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ ≥Χ ΫΈΣFe2O3+ SO2+H2SO4=2FeSO4+ H2OΘ§Νμ“ΜΗωΈΣMnO2ΚΆSO2Α¥Μ·―ßΦΤΝΩ ΐΈΣ 1ΘΚ1 ΖΔ…ζΜ·ΚœΖ¥”ΠΘ§«κ–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_____Θ§ ΗΟΖ¥”Π÷–Ι≤”–_____÷÷‘ΣΥΊΒΡΜ·ΚœΦέΖΔ…ζΝΥΗΡ±δΓΘ
Θ®3Θ©ΓΑ≥ΝΟΧΓ±ΘΚΦ”»κNH4HCO3»ή“ΚΚσΘ§…ζ≥…ΝΥ 4 ÷÷≤ζΈοΘ§Τδ÷–Κ§”–MnCO3≥ΝΒμΚΆΡ≥÷÷Τχ ΧεΘ§–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_____ΓΘ
Θ®4Θ©»ΓΥυΒΟΒΡΗΏ¥ΩMnCO311.7g»ή”ΎΉψΝΩΒΡ―ΈΥα÷–Θ§ΫΪ≤ζ…ζΒΡΤχΧε”ΟΉψΝΩΒΡBa(OH)2≈® »ή“ΚΈϋ ’Θ§ΒΟΒΫΑΉ…Ϊ≥ΝΒμ 19.7gΘ§‘ρΥυΒΟ≤ζΤΖΒΡ¥ΩΕ»ΈΣ_____ΘΞΘ®±ΘΝτ“ΜΈΜ–Γ ΐΘ©
Θ®5Θ©Ρ≥―–ΨΩ–ΓΉι”ΟœΓH2SO4”κΝβΟΧΩσΘ®Κ§”–MnCO3Θ©Ζ¥”Πά¥Ϋΰ≥ωMn2+Θ§ΗΟ―–ΨΩ–ΓΉι―Γ Ε®ΝΫΗω“ρΥΊΉςΈΣ―–ΨΩΧθΦΰΫχ––Ε‘±» Β―ιΘ§ ΐΨί»γœ¬ΘΚ
ΩσΥα±» | Έ¬Ε»/Θ®ΓφΘ© | Ϋΰ≥ω¬ /Θ®%Θ© | |
1 | 1ΘΚ0.5 | 60 | 80.2 |
2 | 1ΘΚ0.5 | 80 | 83.8 |
3 | 1ΘΚ0.6 | 60 | X |
4 | 1ΘΚ0.6 | 80 | 91.8 |
±μ÷– X Ήν”–Ω…ΡήΒΡ ΐ÷ΒΈΣ_____ΓΘ
aΘ°79.7 bΘ°80.8 cΘ°87.6 dΘ°92.8
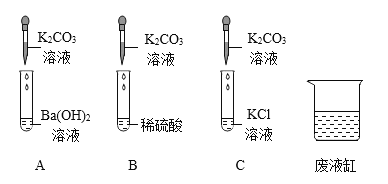
ΓΨΧβΡΩΓΩ‘Ύ20ΓφΜΖΨ≥÷–Θ§÷Τ»ΓΗ…‘οΒΡΕΰ―θΜ·ΧΦΤχΧεΘ§≤Δ―ι÷ΛΕΰ―θΜ·ΧΦΤχΧε”κ«β―θΜ·ΡΤ»ή“ΚΩ…“‘ΖΔ…ζΜ·―ßΖ¥”ΠΘ§…ηΦΤ»γΆΦΧΫΨΩ Β―ιΓΘ
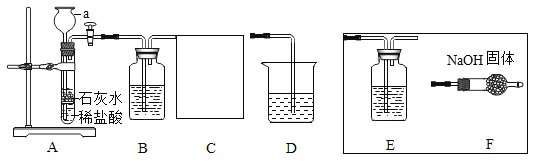
Θ®≤ι‘ΡΉ ΝœΘ©
Θ®1Θ©ΧΦΥαΡΤΓΔΥ°ΓΔΕΰ―θΜ·ΧΦΩ…“‘Μ·Κœ…ζ≥…ΧΦΥα«βΡΤΓΘ
Θ®2Θ©20ΓφΘ§«β―θΜ·ΡΤΓΔΧΦΥαΡΤΚΆΧΦΥα«βΡΤΒΡ»ήΫβΕ»»γœ¬±μΥυ ΨΘΚ
Έο÷ | «β―θΜ·ΡΤ | ΧΦΥαΡΤ | ΧΦΥα«βΡΤ |
»ήΫβΕ»/g | 110 | 21.8 | 9.6 |
Θ®Ε®–‘ΧΫΨΩΘ©
Θ®1Θ©ΉΑ÷ΟF÷–ΒΦΙήΆβΒΡ≤ΘΝß“«ΤςΟϊ≥Τ «_____ΓΘ
Θ®2Θ©ΉΑ÷ΟB÷– Δ”–ΧΦΥα«βΡΤ»ή“ΚΘ§ΡΩΒΡ «Έϋ ’ΉΑ÷ΟA÷–Μ”ΖΔ≥ωΒΡ¬»Μ·«βΤχΧεΘ§–¥≥ωB÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_____ΓΘ
Θ®3Θ©ΉΑ÷ΟCΒΡΉς”Ο «_____Θ§―Γ‘ώ_____Θ®―ΓΧνEΓΔFΘ©ΉΑ÷Ο¥οΒΫ Β―ιΡΩΒΡΓΘ
Θ®4Θ©‘Ύ Β―ιΙΐ≥Χ÷–ΉΑ÷ΟD÷–Ιέ≤λΒΫ_____Θ§ΥΒΟςΕΰ―θΜ·ΧΦΚΆ«β―θΜ·ΡΤ»ή“ΚΡήΖΔ…ζΜ·―ßΖ¥”ΠΓΘ