题目内容
【题目】菱铁矿主要成分是碳酸亚铁(FeCO3),是一种分布广泛的矿物。某同学对碳酸亚铁和氧气充分反应后的固体成分进行了如下探究。
(查阅资料)① FeCO3在空气中加热生成铁的氧化物和二氧化碳。
②FeO是一种黑色粉末,在空气中加热,能迅速被氧化成四氧化三铁。Fe2O3能与盐酸反应生成氯化铁和水。Fe3O4能与盐酸反应生成氯化亚铁、氯化铁和水。
③酸性条件下,FeCl2能使高锰酸钾溶液褪色。向FeCl3溶液中滴加KSCN溶液,溶液变红色。
(猜想与假设)
猜想1:固体成分是Fe2O3 猜想2:固体成分是Fe3O4 猜想3:固体成分是FeO
(进行实验)
利用如图装置进行实验(加热和固定装置已略去,装置气密性良好)。
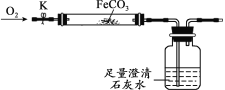
打开弹簧夹K,通入氧气,加热FeCO3。当瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。取玻璃管里的少量固体于试管中,滴加过量盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验。
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(解释与结论)
(1)在实验前就可以判断猜想________(填“1”“2”或“3”)不成立,因为___________。
(2)实验 b 的目的是_____________,由实验a、b的现象可知,猜想__________(填“1”“2”或“3”)成立,则FeCO3与氧气在加热时反应的化学方程式为________________。
(3)该同学反思后发现,不做实验a也能得出相同的结论,理由是___________________。
(拓展与应用)
(4)氧化铁是铁锈的主要成分,写出用盐酸除铁锈的化学方程式______________。
【答案】3 FeO在空气中加热能够迅速被氧化成四氧化三铁 探究乙溶液中是否含有FeCl2 1 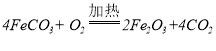 无论哪种猜想中的固体溶于盐酸后,溶液中都含有FeCl3,加入KSCN溶液,溶液都会变红,不能判断固体成分 Fe2O3+6HCl=2FeCl3+3H2O
无论哪种猜想中的固体溶于盐酸后,溶液中都含有FeCl3,加入KSCN溶液,溶液都会变红,不能判断固体成分 Fe2O3+6HCl=2FeCl3+3H2O
【解析】
本题是对碳酸亚铁和氧气充分反应后的固体成分进行探究。
(1)在实验前就可以判断猜想3不成立,因为FeO在空气中加热,能迅速被氧化成四氧化三铁。
(2)根据资料可知,酸性条件下,FeCl2能使高锰酸钾溶液褪色。所以实验 b 的目的是探究乙溶液中是否含有FeCl2;实验a的现象说明溶液中含有FeCl3,、b的现象说明溶液不含FeCl2,综合实验a、b的现象可知猜想1成立;FeCO3与氧气在加热时反应的化学方程式为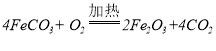 ;
;
(3)猜想3实验前排除了,那么无论猜想1还是猜想2的固体成分与过量的盐酸反应,都有FeCl3生成,加入KSCN溶液,溶液都会变红,不能判断固体成分。因此不做实验a也能得出相同的结论。
(4)氧化铁是铁锈的主要成分,写出用盐酸除铁锈的化学方程式Fe2O3+6HCl=2FeCl3+3H2O。

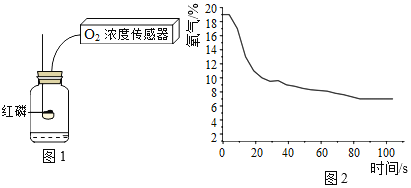
【题目】在利用红磷燃烧测定空气中氧气含量的实验中,用传感器记录集气瓶内氧气浓度随时间变化的情况,如图所示。
(进行实验)
活动1:证明红磷熄灭后,氧气还有剩余
实验装置 | 实验步骤 | 现象 | 结论 |
Ⅰ.用高能激光笔照射燃烧匙中足量的红磷 | 红磷燃烧,放出大量热,一段时间后熄灭,白磷始终不燃烧 | 红磷熄灭后,氧气还有剩余 | |
Ⅱ.冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射 | 白磷 现象① |
(解释与结论)
(1)红磷燃烧的化学方程式为______________________。
(2)步骤Ⅰ中白磷始终不燃烧的原因是__________________。
(3)步骤Ⅱ中的现象①是_______________________。
(4)实验中气球的作用是_______________________。
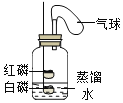
活动2:探究影响剩余氧气浓度的因素
用如图装置进行实验,得到数据如表。
可燃物 | 白磷 | 红磷 | 木炭 |
着火点/℃ | 40 | 240 | 370 |
生成物状态 | 固态 | 固态 | 气态 |
剩余氧气浓度 | 3.1% | 7.0% | 14.0% |
(5)通过对比右表中红磷和白磷的相关数据,可以得出影响剩余氧气浓度的因素可能是________。
(6)结合以上探究及实验数据,在“测定空气中氧气含量”的实验中,通常使用红磷而不用木炭的原因可能有________。