题目内容
【题目】水是生命之源“珍惜水、节约水、保护水“是每个公民的义务和责任。
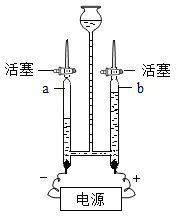
(1)用如图装置进行电解水的实验,实验中观察到的现象是_____,该实验得到的结论是_____。
(2)写出水电解的符号表达式_____。
(3)云南水资源丰富,但分布不均。有些村民用地下水作为生活用水,人们常用_____检验地下水是硬水还是软水:生活中可用_____的方法降低水的硬度。
【答案】在电极上有气泡生成,一段时间后,a管生成的气体是b的气体的2倍 水是氢元素和氧元素组成的 H2O![]() H2+O2 肥皂水 煮沸
H2+O2 肥皂水 煮沸
【解析】
(1)电解水实验时,在玻璃管a、b中观察到的主要现象是:在电极上有气泡生成,一段时间后,a管生成的气体是b的气体的2倍,上述实验得出结论:水是氢元素和氧元素组成的.故填:在电极上有气泡生成,一段时间后,a管生成的气体是b的气体的2倍;水是氢元素和氧元素组成的;
(2)水在通电条件下生成了氢气和氧气,反应的符号表达式是:H2O![]() H2+O2.故填:H2O
H2+O2.故填:H2O![]() H2+O2;
H2+O2;
(3)人们常用肥皂水检验地下水是硬水还是软水:生活中可用煮沸的方法降低水的硬度。故填:肥皂水;煮沸。

 阅读快车系列答案
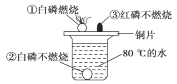
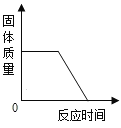
阅读快车系列答案【题目】菱铁矿主要成分是碳酸亚铁(FeCO3),是一种分布广泛的矿物。某同学对碳酸亚铁和氧气充分反应后的固体成分进行了如下探究。
(查阅资料)① FeCO3在空气中加热生成铁的氧化物和二氧化碳。
②FeO是一种黑色粉末,在空气中加热,能迅速被氧化成四氧化三铁。Fe2O3能与盐酸反应生成氯化铁和水。Fe3O4能与盐酸反应生成氯化亚铁、氯化铁和水。
③酸性条件下,FeCl2能使高锰酸钾溶液褪色。向FeCl3溶液中滴加KSCN溶液,溶液变红色。
(猜想与假设)
猜想1:固体成分是Fe2O3 猜想2:固体成分是Fe3O4 猜想3:固体成分是FeO
(进行实验)
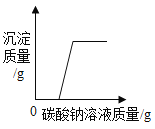
利用如图装置进行实验(加热和固定装置已略去,装置气密性良好)。
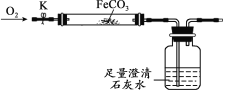
打开弹簧夹K,通入氧气,加热FeCO3。当瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。取玻璃管里的少量固体于试管中,滴加过量盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验。
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(解释与结论)
(1)在实验前就可以判断猜想________(填“1”“2”或“3”)不成立,因为___________。
(2)实验 b 的目的是_____________,由实验a、b的现象可知,猜想__________(填“1”“2”或“3”)成立,则FeCO3与氧气在加热时反应的化学方程式为________________。
(3)该同学反思后发现,不做实验a也能得出相同的结论,理由是___________________。
(拓展与应用)
(4)氧化铁是铁锈的主要成分,写出用盐酸除铁锈的化学方程式______________。