题目内容
【题目】科技改变生活。
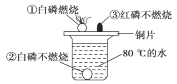
(1)氮气充入食品包装袋防腐,是因为_________________________。
(2)宇航员在太空舱中所需的氧气来自于电解水,其反应的化学方程式为___________。
(3)宇航员太空行走时,需要“人造空气”供给呼吸。这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。“人造空气”中供给呼吸的物质是_____________,“人造空气”中的氮气和空气中的氮气化学性质___________(填“相同”或“不同”)。
(4)修建高铁过程中常用黑火药(含KNO3、S、C)进行工程爆破,黑火药爆炸时产生浓烟,推测该浓烟中含有K2S,从元素守恒角度说明理由___________________。
【答案】氮气化学性质稳定 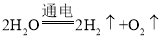 O2 相同 反应物中含有钾、硫元素
O2 相同 反应物中含有钾、硫元素
【解析】
化学与科技、生活紧密相联,应用所学化学知识分析问题,解决问题。
(1)氮气充入食品包装袋防腐,利用氮气无毒且的化学性质稳定,不与食品反应,保护食品。
(2)宇航员在太空舱中所需的氧气来自于电解水,其反应的化学方程式为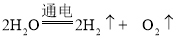 。
。
(3)“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。“人造空气”中的氧气与空气中的氧气,构成的分子相同,化学性质相同,都能供给呼吸和支持燃烧,所以“人造空气”中供给呼吸的物质是O2;“人造空气”中的氮气和空气中的氮气都是由氮分子构成的,化学性质相同。
(4)从黑火药(含KNO3、S、C)成份分析,黑火药爆炸时产生浓烟,该浓烟中含有K2S,理由是根据在化学反应前后元素种类不变,反应前反应物中含有钾、硫元素,生成就有钾、硫元素,所以浓烟中含有K2S。

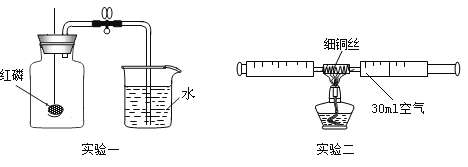
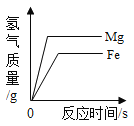
【题目】化学小组的同学们在探究“分子运动”时,设计了如下几组实验:
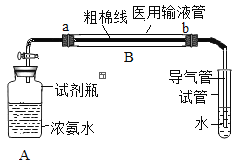
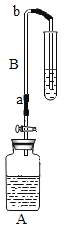
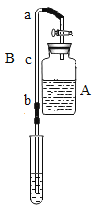
(实验装置)如图,实验1中的装置A取一个60 mL的试剂瓶,盖上一个单孔塞,单孔塞中插入一根带玻璃旋塞的导气管;装置B为一段医用输液管,内置一根浸泡过酚酞试剂并干燥的棉线。用橡胶管将A、B两装置链接。装置A 中加入约20 mL浓氨水,装置B的另一端连接导气管,导气管伸入小试管中。向小试管中加入一定量的蒸馏水。实验2、3、4的装置与实验1基本相同,只是根据实验需要变换了A、B装置和小试管的位置。
(实验步骤)①打开玻璃旋塞,观察现象。②将棉线润湿。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
①干燥棉线没有明显变化。②湿润的棉线由a→b 逐渐匀速变红。 | 湿润的棉线由a→ b迅速变红,并且棉线变红的速率明显高于实验1 | 湿润的棉线由a→ b逐渐变红,并且棉线变红的速率明显低于实验1 装置。c→b 段棉线变红的速率比较缓慢,近b 端甚至不能变红。 | 湿润的棉线逐渐变红,并且a→b 段棉线变红的速率明显高于c→d 段棉线变红的速率 |
(1)以上实验得到的结论是:
①氨气不能使干燥的酚酞变色,氨气与水共同作用能够使酚酞试剂变红;
②_____;
③_____。
(2)若要应用实验1装置探究“温度对分子运动的影响”可以采取的操作是_____。
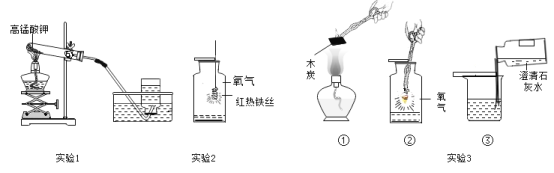
【题目】菱铁矿主要成分是碳酸亚铁(FeCO3),是一种分布广泛的矿物。某同学对碳酸亚铁和氧气充分反应后的固体成分进行了如下探究。
(查阅资料)① FeCO3在空气中加热生成铁的氧化物和二氧化碳。
②FeO是一种黑色粉末,在空气中加热,能迅速被氧化成四氧化三铁。Fe2O3能与盐酸反应生成氯化铁和水。Fe3O4能与盐酸反应生成氯化亚铁、氯化铁和水。
③酸性条件下,FeCl2能使高锰酸钾溶液褪色。向FeCl3溶液中滴加KSCN溶液,溶液变红色。
(猜想与假设)
猜想1:固体成分是Fe2O3 猜想2:固体成分是Fe3O4 猜想3:固体成分是FeO
(进行实验)
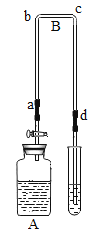
利用如图装置进行实验(加热和固定装置已略去,装置气密性良好)。
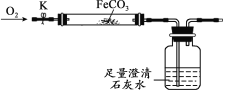
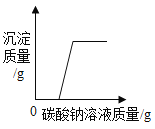
打开弹簧夹K,通入氧气,加热FeCO3。当瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。取玻璃管里的少量固体于试管中,滴加过量盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验。
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(解释与结论)
(1)在实验前就可以判断猜想________(填“1”“2”或“3”)不成立,因为___________。
(2)实验 b 的目的是_____________,由实验a、b的现象可知,猜想__________(填“1”“2”或“3”)成立,则FeCO3与氧气在加热时反应的化学方程式为________________。
(3)该同学反思后发现,不做实验a也能得出相同的结论,理由是___________________。
(拓展与应用)
(4)氧化铁是铁锈的主要成分,写出用盐酸除铁锈的化学方程式______________。