题目内容
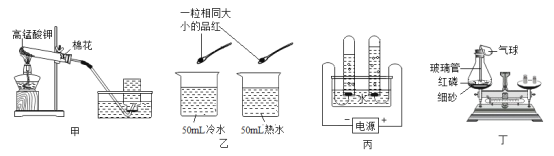
【题目】实验室常用的制取气体的发生装置如图一:
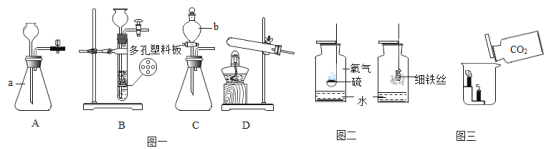
①写出 a、b 仪器的名称_______、_______。
②装置 A 和装置 C 都可制备氧气,指出用装置 C 制备氧气的优点_______。
③用收集好的氧气进行硫粉、铁丝在氧气中燃烧的实验,按图二所示,两个实验的集气瓶底部都放有少量的水,甲集气瓶底部放少量水的目的是_______;乙集气瓶底部放少量水的目的是_______。
④用氯酸钾和二氧化锰为药品制取氧气,应选择的发生装置是_______(填字母),反应的化学方程式是_______。
⑤以碳酸钙和稀盐酸为原料,用装置 B 制备二氧化碳气体,优点是_______;发生反应的化学方程式是_______。
⑥按图三,将一瓶二氧化碳缓缓倒入放有高低两支燃着的蜡烛的烧杯里,可观察到的现象是:_______;此实验说明二氧化碳具有的性质是_______。
【答案】锥形瓶 分液漏斗 装置中分液漏斗可以控制加液的速率,使反应平稳进行 吸收反应生成的二氧化硫,防止其逸出污染环境 防止高温熔融物溅落使集气瓶底部炸裂 D 2KClO3![]() 2KCl+3O2↑ 可以控制反应的发生和停止 CaCO3+2HCl=CaCl2+H2O+CO2↑ 蜡烛由低到高依次熄灭 不可燃也不助燃,密度比空气大
2KCl+3O2↑ 可以控制反应的发生和停止 CaCO3+2HCl=CaCl2+H2O+CO2↑ 蜡烛由低到高依次熄灭 不可燃也不助燃,密度比空气大
【解析】
硫在氧气中点燃生成二氧化硫,铁在氧气中点燃生成四氧化三铁,氯酸钾和二氧化锰加热生成氯化钾和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
①a、b 仪器的名称锥形瓶、分液漏斗。
②装置 A 和装置 C 都可制备氧气,装置 C含有分液漏斗,可以控制过氧化氢的滴加量,故用装置 C 制备氧气的优点是装置中分液漏斗可以控制加液的速率,使反应平稳进行。
③硫在氧气中点燃生成二氧化硫,二氧化硫有毒,故甲集气瓶底部放少量水的目的是吸收反应生成的二氧化硫,防止其逸出污染环境,铁在氧气中点燃生成四氧化三铁,放出大量热,故乙集气瓶底部放少量水的目的是防止高温熔融物溅落使集气瓶底部炸裂。
④氯酸钾和二氧化锰加热生成氯化钾和氧气,用氯酸钾和二氧化锰为药品制取氧气,反应需要加热,故应选择的发生装置是D,反应的化学方程式是2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
⑤碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,以碳酸钙和稀盐酸为原料,用装置 B 制备二氧化碳气体,装置B含有多孔塑料隔板,使固体物质在隔板上,当反应进行时隔板上的固体与液体接触,反应进行;当把止水夹关闭时,产生的气体使压强增大,把液体压入长颈漏斗,隔板上的固体与液体分离,反应停止,故优点是可以控制反应的发生和停止;发生反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑。
⑥二氧化碳密度比空气大,不支持燃烧,不燃烧,按图三,将一瓶二氧化碳缓缓倒入放有高低两支燃着的蜡烛的烧杯里,可观察到的现象是蜡烛由低到高依次熄灭;此实验说明二氧化碳具有的性质是不可燃也不助燃,密度比空气大。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】菱铁矿主要成分是碳酸亚铁(FeCO3),是一种分布广泛的矿物。某同学对碳酸亚铁和氧气充分反应后的固体成分进行了如下探究。
(查阅资料)① FeCO3在空气中加热生成铁的氧化物和二氧化碳。
②FeO是一种黑色粉末,在空气中加热,能迅速被氧化成四氧化三铁。Fe2O3能与盐酸反应生成氯化铁和水。Fe3O4能与盐酸反应生成氯化亚铁、氯化铁和水。
③酸性条件下,FeCl2能使高锰酸钾溶液褪色。向FeCl3溶液中滴加KSCN溶液,溶液变红色。
(猜想与假设)
猜想1:固体成分是Fe2O3 猜想2:固体成分是Fe3O4 猜想3:固体成分是FeO
(进行实验)
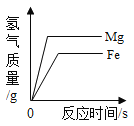
利用如图装置进行实验(加热和固定装置已略去,装置气密性良好)。
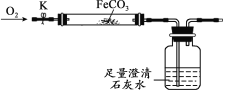
打开弹簧夹K,通入氧气,加热FeCO3。当瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却。取玻璃管里的少量固体于试管中,滴加过量盐酸,微热,固体完全溶解。将所得溶液分成甲、乙两份进行实验。
实验编号 | 实验步骤 | 实验现象 |
a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(解释与结论)
(1)在实验前就可以判断猜想________(填“1”“2”或“3”)不成立,因为___________。
(2)实验 b 的目的是_____________,由实验a、b的现象可知,猜想__________(填“1”“2”或“3”)成立,则FeCO3与氧气在加热时反应的化学方程式为________________。
(3)该同学反思后发现,不做实验a也能得出相同的结论,理由是___________________。
(拓展与应用)
(4)氧化铁是铁锈的主要成分,写出用盐酸除铁锈的化学方程式______________。