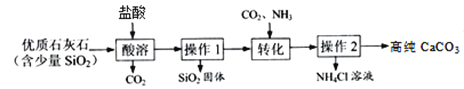
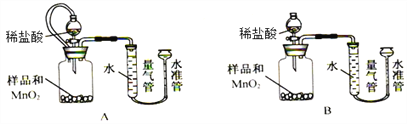
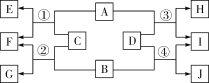
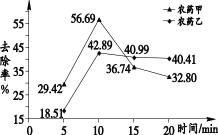
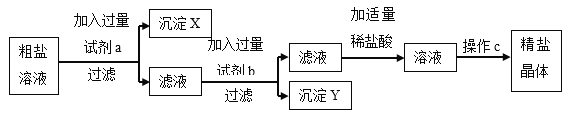
题目内容
【题目】现有一家庭食用纯碱样品,其中含杂质氯化钠(不含其它杂质),为了测定样品中杂质氯化钠的质量分数,李明同学进行了三次实验。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量/g | 15 | 12 | 12 |
加人氯化钙溶液的质量/g | 100 | 100 | 150 |
反应后生成沉淀的质f量/g | 10 | 10 | 10 |
完成下列计算(计算结果精确到0.1%):
(1)样品中氯化钠的质量分数为_____;
(2)加入氯化钙溶液的溶质质量分数_____;
【答案】11.7% 11.1%
【解析】
由图分析可知,实验1与实验2均生成沉淀10g,则实验1中的固体有剩余,加入的氯化钙在两个实验中均完全反应;实验2与实验3均生成沉淀10g,说明实验3中的氯化钙溶液有剩余,则两个实验中的固体样品中的碳酸钠完全反应,所以实验2 中固体样品中的碳酸钠与加入的氯化钙恰好完全反应。
解:参加反应的碳酸钠的质量为x,参加反应的氯化钙的质量为y
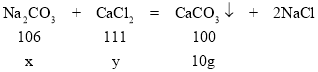
106:100=x:10g x=10.6g
111:100=y :10g y=11.1g
样品中氯化钠的质量分数为![]() ×100%≈11.7%
×100%≈11.7%
加入氯化钙溶液的溶质质量分数为![]() ×100%=11.1%
×100%=11.1%
答:(1)样品中氯化钠的质量分数为11.7%;
(2)加入氯化钙溶液的溶质质量分数为11.1%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
(学生板演)该反应的化学方程式_____.
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(假设猜想)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是_____.
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有_____.
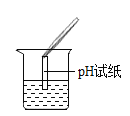
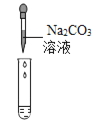
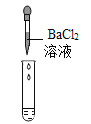
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | ____ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的.
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是_____.
(2)实验方案中也有一个是错误的,错误的原因是_____.