题目内容
【题目】A ~G是初中化学所学的常见物质,A、B常温下为无色气体且组成元素相同,C是黑色固体,D为红色固体,F是大理石的主要成分,其转化关系如图所示(部分反应物、生成物、反应条件已略去),请回答下列问题:
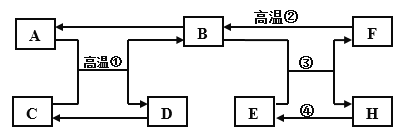
(1)E的用途是:_______。
(2)反应④的基本反应类型是______。
(3)写出反应②的化学方程式:______。
(4)写出反应③的化学方程式:______。
【答案】改良酸性土壤 化合反应 CaCO3![]() CaO+CO2 ↑ Ca(OH)2+CO2 =CaCO3↓+H2O
CaO+CO2 ↑ Ca(OH)2+CO2 =CaCO3↓+H2O
【解析】
A~G是初中所学的常见物质,F是大理石的主要成分,所以F是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,A、B常温下为无色气体且组成元素相同,所以B是二氧化碳,A是一氧化碳,C是黑色固体,D为红色固体,所以C是氧化铜,D是铜,H会转化成E,所以H是水,E是氢氧化钙,经过验证,推导正确;
(1)E是氢氧化钙,常用于改良酸性土壤;
(2)反应④是氧化钙和水反应生成氢氧化钙,符合化合反应多变一的特征;
(3)反应②是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(4)反应③是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。
故答案为:(1)CaCO3;
(2)化合反应;
(3)CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(4)CO2+Ca(OH)2=CaCO3↓+H2O。

【题目】现有一家庭食用纯碱样品,其中含杂质氯化钠(不含其它杂质),为了测定样品中杂质氯化钠的质量分数,李明同学进行了三次实验。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量/g | 15 | 12 | 12 |
加人氯化钙溶液的质量/g | 100 | 100 | 150 |
反应后生成沉淀的质f量/g | 10 | 10 | 10 |
完成下列计算(计算结果精确到0.1%):
(1)样品中氯化钠的质量分数为_____;
(2)加入氯化钙溶液的溶质质量分数_____;