题目内容
【题目】甲同学为区别氢氧化钠和氢氧化钙溶液,设计如下图所示的四组实验方案。
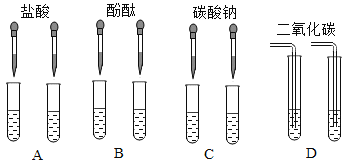
(1)其中能达到实验目的的方案是____________(填字母);
(2)在C组实验中发生的化学方程式为________________;
(3)不属于碱的共同性质的方案是__________(填字母)
【答案】C、D Na2CO3+Ca(OH)2=CaCO3↓+2NaOH C
【解析】
(1)A方案中,氢氧化钠和氢氧化钙都能和盐酸反应,都无明显现象,无法区别;B方案中,两溶液都呈碱性,都能使酚酞变红,无法区别;C方案中,氢氧化钠不能与碳酸钠反应,无明显现象,氢氧化钙与碳酸钠能反应生成碳酸钙沉淀,因此分别加入碳酸钠后,如果无明显现象则该溶液是氢氧化钠溶液,若有沉淀生成,则溶液为氢氧化钙溶液,可以区别;D方案中,氢氧化钠溶液虽然与二氧化碳反应,但生成的碳酸钠溶于水,无明显现象,二氧化碳通入氢氧化钙溶液中会生成沉淀,因此两溶液中分别通入二氧化碳后,若无明显现象,则溶液为氢氧化钠溶液,若溶液变浑浊,则溶液为氢氧化钙溶液,可以区别。故四个方案中能达到实验目的的方案是:C、D。
(2)C组实验中氢氧化钠不能和碳酸钠反应,氢氧化钙和碳酸钠反应生成碳酸钙沉淀,因此C组实验中发生的反应化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(3)碱是解离时生成的阴离子全部是氢氧根离子的化合物,所以碱的共同性质是与碱中氢氧根离子有关的性质,A、B、D方案中的反应都与溶液中的氢氧根离子有关,只有C方案中的反应与溶液中的氢氧根离子无关,氢氧化钙与碳酸钠反应的实质是钙离子和碳酸根离子结合生成碳酸钙沉淀,此反应不属于碱的通性,故四个方案中不属于碱的共同性质的方案是:C。

练习册系列答案
相关题目