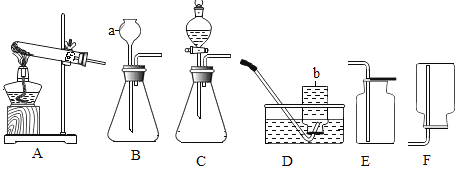
题目内容
【题目】a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )
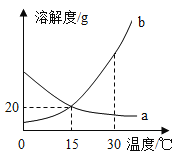
A.15℃时,a、b 的溶解度均为20g
B.加水或升温均可使b的饱和溶液变为不饱和溶液
C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D.分别向100g 水中加入20ga和 b,升温至30℃,所得溶液均 为饱和溶液
【答案】D
【解析】
A、根据溶解度曲线可知15℃时,a、b 的溶解度均为20g,故A正确;
B、b物质的溶解度随温度的升高而增大,所以加水或升温均可使b的饱和溶液变为不饱和溶液,故B正确;
C、a物质的溶解度随温度的降低而增大,所以将 30℃时a的饱和溶液降温至15℃,没有晶体析出,溶液变为不饱和溶液,但溶质的质量分数不变,故C正确;
D、b物质的溶解度随温度的升高而增大,所以向100g 水中加入20ga和b,升温至30℃,所得溶液变为b的不饱和溶液,故D错误.
故选:D.

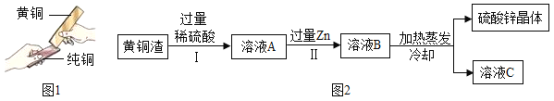
【题目】黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸的用量/克 | 20 | 20 | 20 | 20 |
剩余固体的质量/克 | 20.0 | 17.4 | 14.8 | 13.5 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH_____7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)________毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。________
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
IA | 0 | |||||||
1 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
IIA | IIIA | IVA | VA | VIA | VIIA | |||
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
请根据相关信息与知识回答:
(1)1869年,_____(填序号)发现了元素周期律并编制了元素周期表;
A 拉瓦锡 B 张青莲 C 门捷列夫 D 道尔顿和阿伏加德罗
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为_____。
(3)表中不同种元素最本质的区别是_____(填序号):
A 相对原子质量不同 B 质子数不同 C 中子数不同
(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:_____(填字母序号)
A 从左到右,各元素原子的电子层数相同
B 从左到右,各元素原子的最外层电子数依次增加
C 从左到右,各元素原子的最外层电子数相同
(5)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易_____(填“得到”或“失去”)电子,其离子符号为_____。说明元素的化学性质与原子的_____关系密切。