题目内容
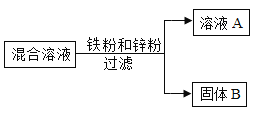
【题目】向含有Cu(NO3)2和AgNO3的混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈蓝色。
(1)写出一定发生的反应的化学方程式_____。
(2)请分析过滤后所得滤液溶质的成分_____。
【答案】Zn+2AgNO3═Zn(NO3)2+2Ag 一定含Cu(NO3)2和Zn(NO3)2,可能含AgNO3
【解析】
根据金属活动顺序表知:锌>铜>银,所以加入锌粉,首先锌粉和硝酸银溶液反应,置换出单质银,如果锌粉足量可以再继续和硝酸铜反应置换出铜。
(1)如果滤液呈蓝色,则说明锌不足,一定发生的反应是锌和硝酸银反应生成硝酸锌和银单质,反应的化学方程式为![]() 。
。
(2)根据金属活动性顺序:Zn>Cu>Ag,把锌粉加入Cu(NO3)2和AgNO3的混合溶液中,先和AgNO3反应置换出AgNO3中的Ag,然后和Cu(NO3)2发生反应置换出Cu(NO3)2中的Cu,在AgNO3和Cu(NO3)2的混合液中,加入一定量的锌粉,充分反应后过滤。如果滤液呈蓝色,则说明锌不足,一定发生的反应是锌和硝酸银反应生成硝酸锌和银单质,滤液中溶质的成分是一定含Cu(NO3)2和Zn(NO3)2,可能含AgNO3。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目