题目内容
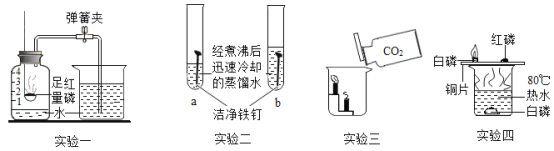
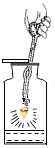
【题目】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
实验序号 | 滴加 | 实验现象 |
① | 第1~6滴 | 产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
(查阅资料)
(1)氢氧化铜在室温下稳定,70℃-80℃时可脱水分解生成氧化铜
(2)铜酸钠![]() 溶于水,溶液呈亮蓝色
溶于水,溶液呈亮蓝色
(猜想与讨论)
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其地同学一致否定了他的猜测,理由是________________________________________。
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
(实验探究)
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验,请你填写表中的空格.
实验序号 | 实验方法与操作 | 实验现象 | 结论 |
③ | 将少许 5mL蒸馏水中,充分振荡 | ________________________ | 猜想一错误 |
④ | ________________________ | ________________________ | 猜想二正确 |
(结论与反思)
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成![]() ,反应的化学方程式是________________________________.
,反应的化学方程式是________________________________.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象________.
【答案】因为若![]() 分解生成的是黑色氧化铜 实验序号③,实验现象沉淀不消失 实验序号④,实验方法与操作将少许
分解生成的是黑色氧化铜 实验序号③,实验现象沉淀不消失 实验序号④,实验方法与操作将少许![]() 粉末加到足量的氢氧化钠将银中,充分振荡 实验序号④ 实验现象 溶液呈亮蓝色
粉末加到足量的氢氧化钠将银中,充分振荡 实验序号④ 实验现象 溶液呈亮蓝色 ![]() 蓝色沉淀逐渐变为黑色
蓝色沉淀逐渐变为黑色
【解析】
猜想与讨论:
根据实验①的现象是沉淀消失,形成亮蓝色溶液,若![]() 分解生成的是黑色氧化铜,因此小陶认为蓝色沉淀消失可能是Cu(OH)2发生了分解是错误的;
分解生成的是黑色氧化铜,因此小陶认为蓝色沉淀消失可能是Cu(OH)2发生了分解是错误的;
实验探究:
③实验的目的否定猜想一,因此加水沉淀不消失;
④实验目的是验证猜想二成立,即是氢氧化铜溶于氢氧化钠溶液产生的亮蓝色的溶液;因此:
实验序号 | 实验方法与操作 | 实验现象 | 结论 |
③ | 将少许 | 沉淀不消失 | 猜想一错误 |
④ | 将少许 | 溶液呈亮蓝色 | 猜想二正确 |
结论与反思:
(1)根据信息Cu(OH)2在NaOH溶液中溶解生成Na2Cu(OH)4,反应的方程式为:Cu(OH)2+2NaOH=Na2Cu(OH)4;
(2)根据表格1可知随着氢氧化钠溶液的滴加,观察到产生蓝色沉淀,且沉淀逐渐增多。振荡后沉淀不消失,很快沉淀逐渐变黑色,结合资料Cu(OH)2在室温下稳定,70℃-80℃时可脱水分解生成CuO,因此说明饱和CuSO4溶液与饱和NaOH溶液的反应是放热反应;根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象蓝色沉淀逐渐变为黑色。

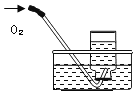
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
选项 | A | B | C | D |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:用水将集气瓶内的空气排净后,便于观察O2何时收集满 |
A.AB.BC.CD.D