题目内容
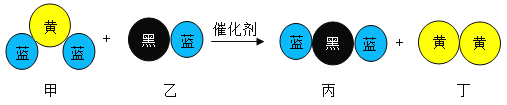
【题目】实验室获取氮气有多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(![]() )和氯化铵的混合溶液加热,氮元素全部转化为氮气。
)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
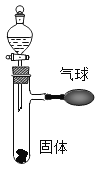
进行试验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_______(填标号)。请写出生石灰在此反应中的两个作用:①_____________;②_____________。
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置______(填标号)_______中加入__________以除去其它杂质气体。
(3)方法三:写出制氮气的化学方程式_____________。
(4)在以上制取氮气的3中方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价_____________。
(5)实验发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大。若上述实验设计与操作均无错误,且氮气己完全干燥,请介绍产生这一现象的原因_____________。
【答案】D 消耗氨水溶液中的水 放出的热量促使氨水挥发、分解而得到氨气 E 球形干燥管 碱石灰 ![]() 铜和氧化铜可循环使用,节省试剂或者避免使用有毒物质而造成污染 方法二制得的氮气中还含有密度比氮气大的稀有气体,导致密度偏大
铜和氧化铜可循环使用,节省试剂或者避免使用有毒物质而造成污染 方法二制得的氮气中还含有密度比氮气大的稀有气体,导致密度偏大
【解析】
(1)用生石灰和浓氨水反应,应该选择固液不加热型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为![]() ,氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程放热,生石灰的两个作用是:①消耗氨水溶液中的水;②放出的热量促使氨水挥发、分解而得到氨气;
,氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程放热,生石灰的两个作用是:①消耗氨水溶液中的水;②放出的热量促使氨水挥发、分解而得到氨气;
(2)空气中除了氮气、氧气外,还有二氧化碳、水蒸气等气体,方法二为将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,利用铜粉和氧气反应除去氧气,要除去二氧化碳、水蒸气等杂质,可以通过碱石灰来吸收,固体干燥剂用装置E盛装;
(3)由题意,亚硝酸钠(![]() )和氯化铵的混合溶液加热,氮元素全部转化为氮气,生成物还有氯化钠和水,化学方程式为
)和氯化铵的混合溶液加热,氮元素全部转化为氮气,生成物还有氯化钠和水,化学方程式为![]() ;
;
(4)从题中信息可知,![]() 和
和![]() 生成
生成![]() 和
和![]() ,而空气和
,而空气和![]() 生成
生成![]() ,故
,故![]() 和
和![]() 可以循环使用,方法三使用有毒的亚硝酸钠,方法一和方法二避免使用有毒物质,不会造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂;避免使用有毒物质而造成污染;
可以循环使用,方法三使用有毒的亚硝酸钠,方法一和方法二避免使用有毒物质,不会造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂;避免使用有毒物质而造成污染;
(5)将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大。

 阅读快车系列答案
阅读快车系列答案【题目】正确分析图表信息可以帮助我们发现规律,解决问题。请你根据下列溶解度数据表与溶解度曲线图回答问题:
温度/℃ 溶解度/g 物质 | 0 | 20 | 40 | 60 | 80 | 100 |
NaCl(氯化钠) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| 72.5 | 64 | 55 | 44.2 | 32.5 | 22 |
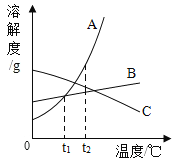
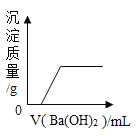
(1)A、B两种物质溶解度相等时的温度大致范围在________℃之间。
(2)![]() ℃时,A、B、C三种物质的溶解度由大到小的顺序为________________________。
℃时,A、B、C三种物质的溶解度由大到小的顺序为________________________。
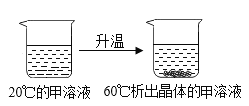
(3)如下图所示,结合上面两个图表分析,甲溶液中溶质对应的溶解度曲线应为________(填序号)。
(4)若将![]() ℃时A、B、C三种物质的饱和的溶液降温至
℃时A、B、C三种物质的饱和的溶液降温至![]() ℃时,溶液的溶质质量分数的大小顺序为__________________________________。
℃时,溶液的溶质质量分数的大小顺序为__________________________________。
【题目】金属A和非金属B可直接合成化合物AB,甲、乙、丙三人分别做A和B化合反应的实验,充分反应时各人所用A和B的质量不同,但总质量都是9g。甲、乙所用A和B的质量及三人得到化合物AB的质量如下表,请填写表中的空格。
A的用量 | B的用量 | 得到的AB的质量 | |
甲 | 7g | 2g | 6g |
乙 | 4g | 5g | 6g |
丙 | __________ | _________ | 7.5g |
【题目】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
实验序号 | 滴加 | 实验现象 |
① | 第1~6滴 | 产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
(查阅资料)
(1)氢氧化铜在室温下稳定,70℃-80℃时可脱水分解生成氧化铜
(2)铜酸钠![]() 溶于水,溶液呈亮蓝色
溶于水,溶液呈亮蓝色
(猜想与讨论)
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其地同学一致否定了他的猜测,理由是________________________________________。
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
(实验探究)
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验,请你填写表中的空格.
实验序号 | 实验方法与操作 | 实验现象 | 结论 |
③ | 将少许 5mL蒸馏水中,充分振荡 | ________________________ | 猜想一错误 |
④ | ________________________ | ________________________ | 猜想二正确 |
(结论与反思)
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成![]() ,反应的化学方程式是________________________________.
,反应的化学方程式是________________________________.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象________.