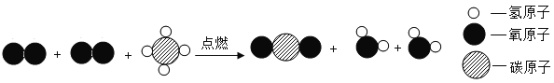
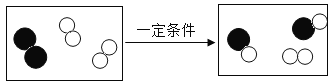
题目内容
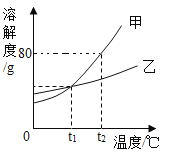
【题目】根据给出的KNO3和NaCl两种物质的溶解度表、溶解度曲线,回答问题。
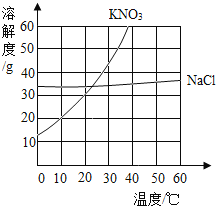
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 (g/100g水) | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)在80℃时,NaCl的溶解度为________g;
(2)在35℃时,KNO3和NaCl两种物质中,溶解度较大的是________________;
(3)将80gKNO3、20gNaCl分别放入100g60℃的水中,充分搅拌,再到20℃,下列有关说法中,正确的是_______________。
A 0℃时有部分KNO3与溶液共存
B 降温到20℃时只有KNO3析出
C 降温到20℃时NaCl已经饱和
【答案】38.4 KNO3 AB
【解析】
(1)由表可知80℃时,NaCl的溶解度为38.4g,故填:38.4;
(2)由溶解度曲线可知,35℃时,KNO3溶解度大于NaCl溶解度,故填:KNO3;
(3)A、0℃时KNO3溶解度小于80g,有一部分硝酸钾不溶解,KNO3与溶液共存,A正确;
B、降温到20℃时KNO3溶解度31.6g小于80gKNO3析出,NaCl的溶解度为36g大于20g氯化钠全部溶解,故只有KNO3析出,B正确;
C、降温到20℃时NaCl的溶解度为36g大于20g氯化钠全部溶解不饱和,C错误;
故选:AB。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目