题目内容
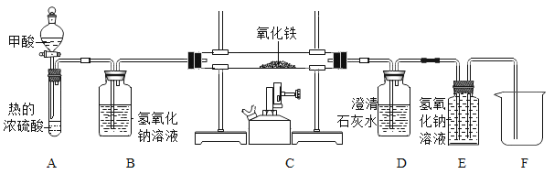
【题目】如图为两种气体发生反应的微观过程,其中不同小球代表不同原子。下列说法正确的是
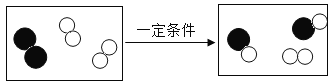
A.化学反应前后分子的种类不变
B.该反应前后各元素化合价均无变化
C.该反应的基本反应类型是化合反应
D.参加反应的![]() 和
和![]() 分子个数比为1:2
分子个数比为1:2
【答案】C
【解析】
A、由图可知,化学反应前后,分子的种类发生了变化,反应前,分子为![]() 和
和![]() ,反应后为
,反应后为![]() ,不符合题意;
,不符合题意;
B、由图可知,反应前两种物质都是由同种元素组成的纯净物,属于单质,反应后为由不同种元素组成的纯净物,属于化合物,故化合价发生了变化,不符合题意;
C、由图可知,该反应符合“多变一”的特点,属于化合反应,符合题意;
D、由图可知,参加反应的![]() 和
和![]() 分子个数比为1:1,有一个
分子个数比为1:1,有一个![]() 分子未参与反应,不符合题意。
分子未参与反应,不符合题意。
故选C。

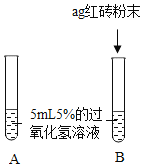
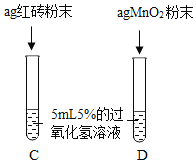
【题目】课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
[提出问题]红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
[实验探究]
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象,B中产生大量能使带火星木条复燃的气体 | ①产生的气体是_ ②___ |
II.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag | 红砖粉末的__在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且 __ | 红砖粉末的催化效果没有二氧化锰粉末好 |
[拓展应用]
己知CuSO4也可作为过氧化氢分解的催化剂。向101g 一定溶质质量分数的过氧化氢溶液中加入2gCuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气__g。
【题目】根据给出的KNO3和NaCl两种物质的溶解度表、溶解度曲线,回答问题。
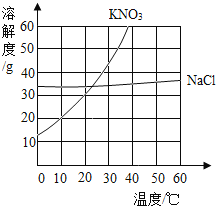
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 (g/100g水) | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)在80℃时,NaCl的溶解度为________g;
(2)在35℃时,KNO3和NaCl两种物质中,溶解度较大的是________________;
(3)将80gKNO3、20gNaCl分别放入100g60℃的水中,充分搅拌,再到20℃,下列有关说法中,正确的是_______________。
A 0℃时有部分KNO3与溶液共存
B 降温到20℃时只有KNO3析出
C 降温到20℃时NaCl已经饱和
【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
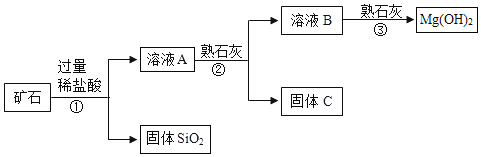
已知氢氧化铜、氢氧化铁和氢氧化镁均是沉淀,请回答下列问题:
(1)步骤①和步骤②均用到的操作是__________,需要的玻璃仪器有烧杯、漏斗和_____________。
(2)溶液 A 中所含的阳离子有 Fe3+、Cu2+、Mg2+和 __________(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的 pH 范围为_______________;固体 C 中所含固体成分的化学式为______________;该步骤②中所涉及的中和反应的化学方程式是______________。
(4)步骤③制取 Mg(OH)2的化学方程式为______________。