��Ŀ����
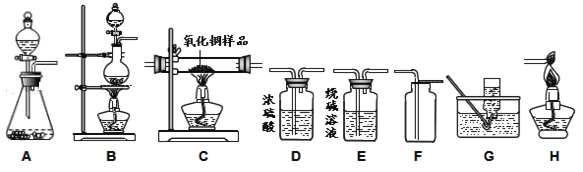
����Ŀ����ͼ��ʾΪʵ�����г����������Ʊ�������ռ�������ʵ��IJ���������
�Ը�����ĿҪ�ش��������⣺
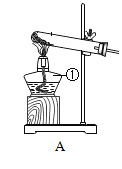
����д������װ��A�Ʊ���һ������Ļ�ѧ��Ӧ����ʽ_____���������ѡ��װ��_____���ռ�����װ����ţ�����ѡ��������_____��
��Сӱͬѧ����������������һ����̼���廹ԭij����ͭ��Ʒ������ֻ��ͭ�������ⶨ�䴿�ȡ�
���������ϣ�
�����ᣨH2C2O4��������Ũ�����ϼ��ȣ������һ����̼�����壬�䷴Ӧԭ��Ϊ��H2C2O4 CO��+CO2��+H2O��
CO��+CO2��+H2O��
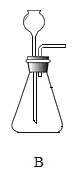
����Сӱͬѧѡ�ò�������ȡCO���䷢��װ����Ӧѡ��_____����װ����ţ���
������ʵ�飩
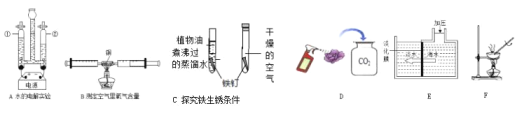
��Сӱͬѧ���õ��ӳӳ�ȡ��1.00g����ͭ��Ʒ������װ��C�еIJ������ڲ���װ����������������ٽ�����ֽ�õ���������ﰴ����������������˳�����ʵ�飺��������D��C��E��H�����ͨ��������Ӧǰ��װ��E�������仯���м��㡣����֪��CO+CuO![]() Cu+CO2��ʵ������У���װ��C�Ĵ������ڿɹ۲쵽��������_____��
Cu+CO2��ʵ������У���װ��C�Ĵ������ڿɹ۲쵽��������_____��
�������������ʵ�鷽�����ڵIJ���֮������Ӧ�ĸĽ�����_____��
��ʵ��Ľ���Сӱͬѧ��ʵ�����õ���ȷ���ݽ��з������������������ķ�Ӧ����ȫ���У���ͨ���ⶨ����װ��C�е�����ͭȫ������ԭ��װ��E������������0.33g�������Ʒ������ͭ����������Ϊ_____�������ȷ��0.1%����
��С��ͬѧ��������飬����Ϊ������ʵ�鷽�������ԸĽ���Ҳ����ȷ���������Ʒ������ͭ�Ĵ��ȣ����ļ������ݻ�Ϊ��_____��
���𰸡�CaCO3 + 2HCl == CaCl2 + H2O + CO2�� F ������̼�ܶȱȿ����� B ��ɫ�����ɺ�ɫ Ӧ��װ��Dǰ����װ��һ��װ��E�����ջ�������еĶ�����̼ 60.0% ����H2C2O4![]() CO��+CO2��+H2O�����ɵ�һ����̼�Ͷ�����̼�ķ��Ӹ�����Ϊ1:1�Ĺ�ϵ��װ��E���ӵ�������һ���������ͭ��һ����̼��Ӧ���ɵĶ�����̼���������ٸ��ݲ���ܵļ��㷽�����������ͭ����������
CO��+CO2��+H2O�����ɵ�һ����̼�Ͷ�����̼�ķ��Ӹ�����Ϊ1:1�Ĺ�ϵ��װ��E���ӵ�������һ���������ͭ��һ����̼��Ӧ���ɵĶ�����̼���������ٸ��ݲ���ܵļ��㷽�����������ͭ����������
��������
��װ��AΪ��Һ�������ͣ�������ʵ������ȡ������̼����ѧ��Ӧ����ʽΪ��CaCO3 + 2HCl = CaCl2 + H2O + CO2�����������ѡ��װ��F���ռ���ѡ�������Ƕ�����̼�ܶȱȿ�����
���CaCO3 + 2HCl =CaCl2 + H2O + CO2����F��������̼�ܶȱȿ�����
��2��[��������]
H2C2O4 CO��+CO2��+H2O���÷�ӦΪ�����Һ�巴Ӧ����Ҫ���ȣ�
CO��+CO2��+H2O���÷�ӦΪ�����Һ�巴Ӧ����Ҫ���ȣ�
����Сӱͬѧѡ�ò�������ȡCO���䷢��װ����Ӧѡ��B��
���B��
[����ʵ��]
������ͭ��һ����̼�ڼ��������·�Ӧ����ͭ�Ͷ�����̼����װ��C�Ĵ������ڿɹ۲쵽�������Ǻ�ɫ�����ɺ�ɫ��
�����ɫ�����ɺ�ɫ��
������ʵ�鷽���л��������D��C��E��H��Ӧ��װ��Dǰ����װ��һ��װ��E�����ջ�������еĶ�����̼��
������Ʒ������ͭ����������Ϊx
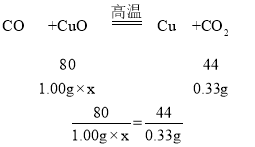
x=60.0%��
��С��ͬѧ��������飬����Ϊ������ʵ�鷽�������ԸĽ���Ҳ����ȷ���������Ʒ������ͭ�Ĵ��ȣ����ļ������ݻ�Ϊ������H2C2O4 CO��+CO2��+H2O�����ɵ�һ����̼�Ͷ�����̼�ķ��Ӹ�����Ϊ1:1�Ĺ�ϵ��װ��E���ӵ�������һ���������ͭ��һ����̼��Ӧ���ɵĶ�����̼���������ٸ��ݲ���ܵļ��㷽�����������ͭ���������ɡ�
CO��+CO2��+H2O�����ɵ�һ����̼�Ͷ�����̼�ķ��Ӹ�����Ϊ1:1�Ĺ�ϵ��װ��E���ӵ�������һ���������ͭ��һ����̼��Ӧ���ɵĶ�����̼���������ٸ��ݲ���ܵļ��㷽�����������ͭ���������ɡ�

����Ŀ�����ݸ�����KNO3��NaCl�������ʵ��ܽ�ȱ����ܽ�����ߣ��ش����⡣
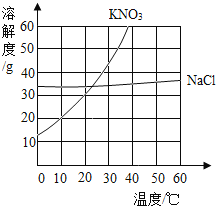
�¶ȣ����� | 0 | 20 | 40 | 60 | 80 | 100 | |
�ܽ�� ��g/100gˮ�� | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
��1����80��ʱ��NaCl���ܽ��Ϊ________g��
��2����35��ʱ��KNO3��NaCl���������У��ܽ�Ƚϴ����________________��
��3����80gKNO3��20gNaCl�ֱ����100g60����ˮ�У���ֽ��裬�ٵ�20���������й�˵���У���ȷ����_______________��
A 0��ʱ�в���KNO3����Һ����
B ���µ�20��ʱֻ��KNO3����
C ���µ�20��ʱNaCl�Ѿ�����