题目内容
【题目】下列说法正确的是( )
A.等质量的镁与氧化镁混合,其混合物中镁、氧两种元素的质量比为5:2
B.铁和锌的混合物6g与足量的稀盐酸反应,生成氢气的质量可能为0.2g
C.将100mL 50%的某溶液与100mL水混合,所得溶液的溶质质量分数一定为25%
D.现有氧化铜和氧化铁的混合物10g与100g溶质质量分数为14.7%的稀硫酸恰好完全反应,则混合物中氧元素的质量分数为24%
【答案】BD
【解析】
A、设镁和氧化镁的质量都为mg,则混合物中镁、氧两种元素的质量比为(mg+mg×![]() ×100%):(mg×
×100%):(mg×![]() ×100%)=4:1而非5:2.错误;
×100%)=4:1而非5:2.错误;
B、假设6g都是铁,生成的氢气的质量为x
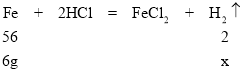
![]()
x≈0.21g
假设6g都是锌,生成的氢气的质量为y。

![]()
y≈0.19g
所以铁和锌的混合物6g与足量的稀盐酸反应,生成氢气的质量可能为0.2g。正确;
C、体积不能简单相加,所以无法计算等体积液体混合后的质量分数(不说明密度的前提下)。错误;
D、设混合物中氧元素的质量分数为x
根据硫酸中的氢元素与混合物中的氧元素结合成水可得关系式为

![]()
x=24%.正确。
故选:BD。

练习册系列答案
相关题目