题目内容
【题目】用图所示装置探究可燃物的燃烧条件。实验过程如下:①将白磷放在燃烧匙内,塞好胶塞;②从长颈漏斗向瓶内迅速注入60℃的水至刚刚浸没白磷;③连接好注射器,向瓶内推入空气,瓶内水面下降,当白磷露出水面时立即燃烧,停止推入空气:④白磷熄灭后,瓶内水面上升,最后淹没白磷。请同答下列问题:
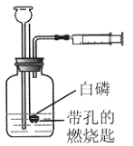
(1)白磷燃烧的化学方程式为_____。
(2)推测白磷的着火点比60℃_____(“高”或“低”)。
(3)③中实验现象说明燃烧需要的条件是_____。
(4)④中瓶内水面上升的原因_____。
【答案】4P+5O2![]() 2P2O5 低 必须与氧气接触 白磷燃烧消耗瓶内氧气,生成的P2O5是固体,瓶内气体减少,压强减小,形成压强差
2P2O5 低 必须与氧气接触 白磷燃烧消耗瓶内氧气,生成的P2O5是固体,瓶内气体减少,压强减小,形成压强差
【解析】
(1)白磷燃烧生成五氧化二磷。
(2)白磷燃烧,说明温度已经达到着火点。
(3)③中没有接触氧气,白磷没有燃烧,接触氧气立即燃烧。
(4)白磷燃烧消耗瓶内氧气,生成的P2O5是固体。
(1)白磷燃烧生成五氧化二磷,化学方程式为4P+5O2![]() 2P2O5。
2P2O5。
(2)白磷燃烧,说明温度已经达到着火点,推测白磷的着火点比60℃低。
(3)③中白磷没有接触氧气,白磷没有燃烧,接触氧气立即燃烧,实验现象说明燃烧需要的条件是必须与氧气接触。
(4)④中瓶内水面上升的原因白磷燃烧消耗瓶内氧气,生成的P2O5是固体,瓶内气体减少,压强减小,形成压强差。

【题目】碳和碳组成的化合物是初中化学研究的重要内容,请认真阅读题目,完成下列问题。
(1)现代生活倡导“低碳生活”,主要是为了减少_______(填化学式)的排放量。
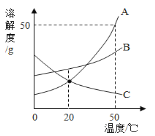
(2)组成化合物种类最多的元素是碳,如图所示,是元素周期表的一格。下列说法不正确的是__________。

A碳属于非金属元素 B碳元素的相对原子质量为12.01g
C碳原子中含有6个中子 D碳元素位于元素周期表的第ⅥA族
(3)吹不灭的蜡烛实验中,蜡烛中混有镁粉。已知镁条在二氧化碳气体中燃烧生成碳和氧化镁,请书写其化学方程式为__________;根据上述内容,你对燃烧知识有何新认识_________。
(4)如图是初中化学中常见仪器装置,回答下列问题:

①用大理石和稀盐酸制取并收集二氧化碳,可选用的装置是________,为防止气体从发生装置泄漏的必要措施是___________。
②F装置有多种用途。除去一氧化碳中的二氧化碳时,瓶中液体可以是_________。
A浓硫酸 B烧碱溶液 C浓盐酸 D饱和的碳酸氢钠溶液
(5)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用45g石灰石样品,把200g稀盐酸分四次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量 | 第一次加入50g | 第二次加入50g | 第三次加入50g | 第四次加入50g |
剩余固体的质量 | 35g | 25g | 15g | 9g |
请计算该盐酸的溶质质量分数________。
【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
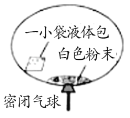
(查阅资料)该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)通常用澄清的石灰水来检验气体是二氧化碳,该反应的化学方程式 为_____。
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈_____性。
(3)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)
实验一:完成下表:
操作步骤 | 现象 | 结论 |
_____ | _____ | 甲同学的猜想不正确 |
实验二:室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积(装置如图),记录如下表:
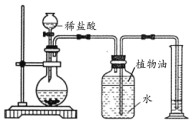
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(4)实验装置中植物油的作用是_____;表中a=_____;V1_____V2(填“﹥”、“﹤”或“=”)。
(分析并得出结论)
(5)分析上表中数据得出结论:白色粉末的成分是_____,依据是_____。