题目内容
【题目】我国是海洋大国,浩瀚的海洋为我们提供了丰富的资源,为了保卫我们神圣的海权,近年来我国对南海部分岛礁进行了吹填扩建,为海洋资源的开发利用提供了便利条件。
(1)我们的食用盐大部分来自于海水,从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,可以将粗盐溶于水,然后进行如下操作:
①加过量的Ba(OH)2溶液;②加适量的盐酸;③加过量的Na2CO3溶液;④过滤;⑤蒸发。正确的操作顺序是_______(填字母)。
(2)如图是氯化钠、氢氧化钠两种固体物质的溶解度曲线。
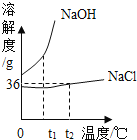
①t1℃时,NaCl饱和溶液中溶质质量分数________NaOH饱和溶液中溶质质量分数(填“大于”、“小于”、“等于”之一)
②t2℃时,将 20gNaCl固体投入 50g水中,充分溶解后可得到NaCl的_____(填“不饱和溶液”或“饱和溶液”,此时所得溶液的质量是________g。
【答案】①③④②⑤ 小于 饱和溶液 68
【解析】
(1)在粗盐提纯的过程中,加过量的Ba(OH)2溶液的目的是除去硫酸根离子和镁离子;②加适量的盐酸目的是除去过量的氢氧根离子和碳酸根离子;③加过量的Na2CO3溶液的目的是除去钙离子和过量的钡离子;Ba(OH)2的加入必须在Na2CO3溶液之前,过滤后才能加盐酸,据此得出操作顺序为:①③④②⑤;
(2)①饱和溶液中溶质的质量分数=![]() ,即溶解度大的饱和溶液溶质的质量分数大,t1℃时,NaCl的溶解度小于NaOH的溶解度,故NaCl饱和溶液中溶质质量分数小于NaOH饱和溶液中溶质质量分数;
,即溶解度大的饱和溶液溶质的质量分数大,t1℃时,NaCl的溶解度小于NaOH的溶解度,故NaCl饱和溶液中溶质质量分数小于NaOH饱和溶液中溶质质量分数;
②t2℃时,氯化钠的溶解度是36g,即100g水中最多溶解36g的氯化钠,所以将20g氯化钠固体投入50g水中只能溶解18g,所以得到的是NaCl的饱和溶液,溶液质量=18g+50g=68g。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】为制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验
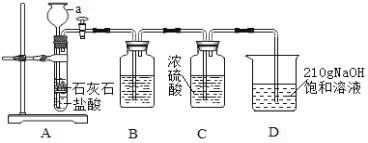
(资料)①碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
②20℃时,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示。
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
假设:实验过程中装置D的温度维持在20℃,请根据设计的装置和资料回答问题:
(定性探究)
(1)仪器a的名称是_____________,要使A中反应停止,最简便的操作方法是__________________。
(2)装置B中盛有 NaHCO3溶液,作用是吸收装置A中挥发出的HC气体,B中发生反应的基本反应类型是____________反应(选填:“化合”、“分解”、“置换”、“复分解”)。
(3)装置C的作用是________________________________________。
(4)在实验过程中装置D中观察到______________________________,说明CO2和NaOH溶液能发生反应,当通入装置D中的CO2过多时,还会与Na2CO3化合成 NaHCO3,该反应的化学方程式是_________________________。
【题目】某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
(1)小丽要测定某地采集到的雨水是否为酸雨,已知pH小于5.6的降水称为酸雨,下列提供的试剂(试纸)中宜取用_______
A 蓝色石蕊试纸 B 紫色石蕊溶液 C 无色酚酞试剂 D pH试纸
(2)小刚探究氢氧化钙的化学性质时分别用澄清石灰水与以下四种物质反应:

I.写出小刚进行的四个实验中无明显现象产生的反应的化学方程式____。
II.若采用另一种盐的溶液取代Na2CO3溶液与澄清石灰水反应,小刚应选择的物质是__。
A BaCl2 B NaCl C FeCl3 D Ba(NO3)2
(3)小雨对碳酸钙高温加热一段时间,得到一些剩余固体。她对这些剩余固体的成分进行了探究。
(提出问题)剩余固体成分是什么?
(猜想与假设)剩余固体成分为:
A 全部是碳酸钙 B 既有碳酸钙,也有氧化钙 C 全部是氧化钙
(设计并完成实验)
实验操作 | 实验现象 | 实验结论 |
a. 取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有__ |
b.再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有___ |
(实验结论)该化学兴趣小组同学得出的结论:
剩余固体成分与(猜想与假设)中的______ (填“A”“B”或“C”)符合。
(交流与反思)实验操作b产生的气体是_______,如何检验是该气体________;剩余固体的成分若与C相符,则两步操作的实验现象_____(填“a”或“b”或“ab”)不同。