题目内容
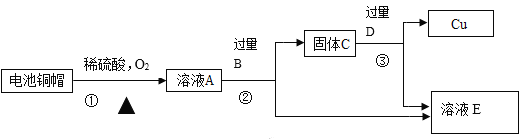
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿的空气中易变质。CuCl的制备流程如下:
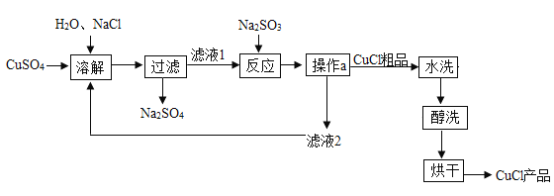
(1)CuCl中铜元素的化合价是_______________;“操作a”的名称是_________________。
(2)“滤液1”中除了含有Na+、Cl-、SO42-外,还含有较多的离子是_________________。
(3)“反应”中发生反应的化学方程式是![]() ,产生的X迅速与水化合生成一种酸,该反应的化学方程式为_________________。
,产生的X迅速与水化合生成一种酸,该反应的化学方程式为_________________。
(4)本流程中可以循环利用的物质(水除外)是______________ (填化学式);醇洗的目的是_________________。
【答案】+1 过滤 Cu2+(或铜离子) ![]() NaCl 除去水,防止CuCl变质
NaCl 除去水,防止CuCl变质
【解析】
(1)CuCl中氯元素为-1价,则铜元素的化合价是+1价;“操作a”将溶液与滤渣分离的名称是过滤。
(2)“滤液1”中除了含有Na+、Cl-、SO42-外,还含有较多的离子是铜离子,因为硫酸铜与水和氯化钠全部溶解,过滤后得到硫酸钠,氯化铜,溶液中一定含有铜离子。
(3)“反应”中发生反应的化学方程式是![]() ,该反应符合质量守恒定律,反应物比生成物多1个硫原子和3个氧原子,则X是三氧化硫(SO3),三氧化硫与水反应产生硫酸的化学方程式为:
,该反应符合质量守恒定律,反应物比生成物多1个硫原子和3个氧原子,则X是三氧化硫(SO3),三氧化硫与水反应产生硫酸的化学方程式为:![]() 。
。
(4)本流程中可以循环利用的物质是氯化钠(NaCl);因为氯化钠既是反应物又是生成物;CuCl难溶于水和乙醇,在潮湿的空气中易变质;醇洗的目的是:除去水,防止CuCl变质。

练习册系列答案
相关题目