题目内容
【题目】注射器的运用对某些化学实验现象的观察或实验过程的改进常常起到了意想不到的效果。
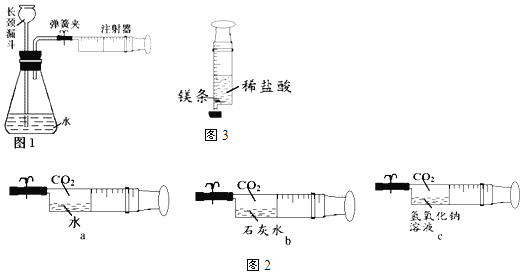
(1)检查装置的气密性(如图1)
连接好装置(注射器内留有一半体积的空气),打开弹簧夹,向长颈漏斗中注入水,使其下端管口形成液封,然后慢慢推注射器的活塞,看到______现象,则说明装置的气密性良好。
(2)探究CO2的性质(如图2)
用注射器吸收液体和CO2(体积比均为1:5),然后夹紧弹簧夹,用力振荡。
①依据______(填“a、b或c”)现象的对比,可认为氢氧化钠和二氧化碳发生反应,写出该反应的化学方程式______。
②若要证明a中也发生了化学反应,你的实验方案是(写出操作、现象)______。
(3)探究镁与盐酸的反应(如图3)
将一小块镁条放在注射器中,再吸取10mL的稀盐酸,迅速封住注射器的尖嘴部分。完毕后注射器中镁条有剩余,向试液中滴入两滴酚酞溶液,溶液变红。
(查阅资料)氢氧化镁微溶于热水,且溶解度随温度升高而增大。
(提出猜想)猜想Ⅰ:氯化镁溶液呈碱性使酚酞变成红色;
猜想Ⅱ:镁与热水反应后生成碱使酚酞变红色。
(实验与思考)
①为验证猜想Ⅰ,需测定______溶液的酸碱性,实验表明该溶液显弱酸性。
②为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧。请根据以上现象写出镁与热水反应的化学方程式______。
③在进行上述猜想Ⅱ的探究时,发现实验一段时间后,酚酞的红色总是会逐渐消失。
甲同学猜想:可能是镁与热水反应后生成的碱逐渐被空气中的______反应掉了;
乙同学猜想:可能是水温逐渐降低,导致氢氧化镁的溶解度变小。
请你设计一个简单的实验方案验证乙同学的猜想(写出相应的操作、现象和结论)______。
【答案】长颈漏斗中的水上升 ac 2NaOH+CO2=Na2CO3+H2O 打开弹簧夹,吸入少量石蕊试液,溶液变红色 氯化镁 Mg+2H2O(热)=Mg(OH)2+H2↑ 二氧化碳 实验步骤:取两支试管,分别加入相同体积的冷水和热水,再分别滴加两滴酚酞试液,最后分别加入形状、质量相同的氢氧化镁;
实验现象:冷水中的液体不变色,热水中的液体变红色;
实验结论:水温逐渐降低,会导致氢氧化镁的溶解度变小
【解析】
(1)连接好装置(注射器内留有一半体积的空气),打开弹簧夹,向长颈漏斗中注入水,使其下端管口形成液封,然后慢慢推注射器的活塞,看到长颈漏斗中的水上升,则说明装置的气密性良好,故填长颈漏斗中的水上升。
(2)①依据ac现象的对比可知,c中活塞右移幅度比a中大,可认为氢氧化钠和二氧化碳发生反应,故填ac;
氢氧化钠和二氧化碳反应生成碳酸钠和水,故反应的化学方程式写为:2NaOH+CO2═Na2CO3+H2O。
②若要证明a中也发生了化学反应,实验方案:打开弹簧夹,吸入少量石蕊试液,溶液变红色,说明二氧化碳和水反应生成了显酸性物质,故填打开弹簧夹,吸入少量石蕊试液,溶液变红色。
(3)[实验与思考]①为验证猜想Ⅰ,需测定氯化镁溶液的酸碱性,实验表明该溶液显弱酸性,故填氯化镁。
②为验证猜想Ⅱ,在滴有两滴酚酞的热水中放入一段镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气泡产生,收集并点燃该气体,发现气体能燃烧。根据以上现象可知,镁与热水反应生成氢氧化镁和氢气,故反应的化学方程式写为:Mg+2H2O(热)=Mg(OH)2+H2↑。
③甲同学猜想:可能是镁与热水反应后生成的碱逐渐被空气中的二氧化碳反应掉,这是因为二氧化碳能和溶于水的碱反应生成盐和水,故填二氧化碳;
实验方案验证乙同学的猜想:实验步骤:取两支试管,分别加入相同体积的冷水和热水,再分别滴加两滴酚酞试液,最后分别加入形状、质量相同的氢氧化镁,故填取两支试管,分别加入相同体积的冷水和热水,再分别滴加两滴酚酞试液,最后分别加入形状、质量相同的氢氧化镁;
实验现象:冷水中的液体不变色,热水中的液体变红色,故填冷水中的液体不变色,热水中的液体变红色;
实验结论:水温逐渐降低,会导致氢氧化镁的溶解度变小,故填水温逐渐降低,会导致氢氧化镁的溶解度变小。

 阅读快车系列答案
阅读快车系列答案【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。化学小组的同学从草木灰中提取钾盐,并检验其部分成分。请根据部分盐溶解性表和学过的知识回答下列问题:
部分盐的溶解性表(室温)
阴离子/阳离子 | NO3﹣ | Cl﹣ | SO42﹣ | CO32﹣ |
K+ | 溶 | 溶 | 不 | 溶 |
Ba2+ | 溶 | 溶 | 不 | 不 |
Ca2+ | 溶 | 溶 | 微 | 不 |
Ag+ | 溶 | 不 | 微 | 不 |
实验一:分离提纯
①取适量草木灰样品,研碎。
②将研碎的草木灰样品置于烧杯中,加入适量的蒸馏水溶解。
③过滤
④蒸发结晶。将滤液加入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌。
步骤③过滤需要的玻璃仪器有_____;
步骤④中,用玻璃棒搅拌的目的是_____。
实验二:验证成分
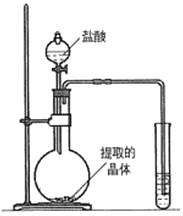
(1)验证碳酸钾存在:取少量实验一所得的晶体置于烧瓶中,按如图所示的装置实验,则试管中装的药品是_____,证明晶体中含有碳酸钾的实验现象是_____。烧瓶中发生反应的化学方程式是_____。
(2)验证硫酸钾存在:
甲同学取少量实验一所得的晶体于试管中,加蒸馏水溶解后,再加入氯化钡溶液,产生白色沉淀,于是他得出晶体中含有硫酸钾的结论。
乙同学认为,甲同学的方案不合理,其理由是:_____。
乙同学继续向甲同学所得白色沉淀中加入过量的_____,观察到_____,证明了晶体中硫酸钾的存在。
【题目】不同温度下,碳酸钠和碳酸氢钠的溶解度如下表所示
温度/℃ 溶解度/g | 0 | 20 | 40 | 60 |
碳酸钠 | 7.0 | 21.8 | 48.8 | 46.4 |
碳酸氢钠 | 6.9 | 9.6 | 12.7 | 16.4 |
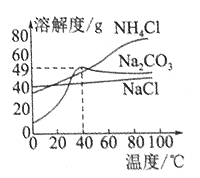
⑴ 服用碳酸氢钠治疗胃酸过多时,胃液的pH________(填“增大”、“减小”或“不变”),发生反应的化学方程式是____________________。
⑵为区分碳酸钠和碳酸氢钠两种白色固体。在20℃时,各盛有100mL水的甲、乙两烧杯中,分别加入等质量的碳酸钠和碳酸氢钠固体,充分溶解后,现象如图所示。

甲烧杯中加入的物质是________(填化学式),加入的质量m的范围为:______________。