��Ŀ����
����Ŀ����ͬ�¶��£�̼���ƺ�̼�����Ƶ��ܽ�����±���ʾ
�¶�/�� �ܽ��/g | 0 | 20 | 40 | 60 |
̼���� | 7.0 | 21.8 | 48.8 | 46.4 |
̼������ | 6.9 | 9.6 | 12.7 | 16.4 |
�� ����̼����������θ�����ʱ��θҺ��pH________������������������С����������������������Ӧ�Ļ�ѧ����ʽ��____________________��
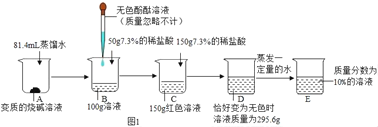
��Ϊ����̼���ƺ�̼���������ְ�ɫ���塣��20��ʱ����ʢ��100mLˮ�ļס������ձ��У��ֱ�����������̼���ƺ�̼�����ƹ��壬����ܽ��������ͼ��ʾ��

���ձ��м����������________���ѧʽ�������������m�ķ�ΧΪ��______________��
���𰸡����� NaHCO3+HCl=NaCl+H2O+CO2�� NaHCO3 ����9.6gС�ڵ���21.8g
��������
��1��̼�����ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�����ᱻ���ģ�θҺ��pH������Ӧ�Ļ�ѧ����ʽΪNaHCO3+HCl=NaCl+H2O+CO2����
��2��20��ʱ��̼�����Ƶ��ܽ��Ϊ9.6g��̼���Ƶ��ܽ��Ϊ21.8g��������20��ʱ����ʢ��50mLˮ�ļס������ձ��У��ֱ�����������̼���ƺ�̼�����ƹ��壬����ȫ���ܽ����̼�����ƣ���ȫ���ܽ����̼����, ���ձ��м����������NaHCO3����100gˮ���������ʼ����������Χ����̼�������ܽ�ȵģ�С��̼�����ܽ�ȣ���Ϊ����50gˮ���������ʼ����������Χ����9.6gС�ڵ���21.8g��

 ��ĩ�����ϵ�д�
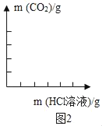
��ĩ�����ϵ�д�����Ŀ��ij��ѧʵ��С���ͬѧ������ͼ��ʾװ�ý���ʵ�顣A�з�Ӧ��ʼʱ�����ɼ�C���ڴ�״̬��һ��ʱ��ر�C��װ��A�����ڷ�Ӧ����һ������۲쵽װ��A��Һ��ͨ�������ܽ���װ��B��װ��B�г��ְ�ɫ������װ��A��Һ���ܽ���װ��B��ԭ��____________��װ��B�г��ְ�ɫ�����Ļ�ѧ��Ӧ����ʽΪ____________��С��ͬѧ̽����Ӧ��װ��B����Һ�����ʳɷ֡�
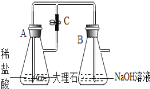
��������⣩��Ӧ��װ��B��Һ�����ʳɷ���ʲô��
����������裩����1��NaCl��CaCl2 ����2��NaCl��HCl�� ����3��NaCl��NaOH�� ����4��NaCl��NaOH��Na2CO3��
���������ۣ������ۣ����һ����Ϊ����________һ����������������________��
��ʵ��̽��������Ӧ��װ��B�����û������ˣ�ȡ������Һ�ֱ��������ʵ�飺
ʵ��1������Һ�еμ�̼������Һ�����������������________����ȷ��
ʵ��2��С��ͨ����һ����ʵ��֤������4��ȷ������������ĺ����ϰ�����ȫʵ�����������
ʵ����� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У�Ȼ���ȵμ�������ɫ��̪��Һ���ټ���______��Һ�� | _______ | ������4������ |
����չ���죩С�����һ�����Ƶļ���ʱ�������֡��������������д���𰸡�ȡ6g���ֱ��ʵ�NaOH������Ʒ������73g���ʵ���������Ϊ10����ϡ�����ַ�Ӧ�����pHС��7���ٵμ�8mL��NaOH��Һ�����pHǡ��Ϊ7���������õ���Һ���õ��ľ��������Ϊ_____��