题目内容
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。化学小组的同学从草木灰中提取钾盐,并检验其部分成分。请根据部分盐溶解性表和学过的知识回答下列问题:
部分盐的溶解性表(室温)
阴离子/阳离子 | NO3﹣ | Cl﹣ | SO42﹣ | CO32﹣ |
K+ | 溶 | 溶 | 不 | 溶 |
Ba2+ | 溶 | 溶 | 不 | 不 |
Ca2+ | 溶 | 溶 | 微 | 不 |
Ag+ | 溶 | 不 | 微 | 不 |
实验一:分离提纯
①取适量草木灰样品,研碎。
②将研碎的草木灰样品置于烧杯中,加入适量的蒸馏水溶解。
③过滤
④蒸发结晶。将滤液加入蒸发皿中,用酒精灯加热,并用玻璃棒不断搅拌。
步骤③过滤需要的玻璃仪器有_____;
步骤④中,用玻璃棒搅拌的目的是_____。
实验二:验证成分
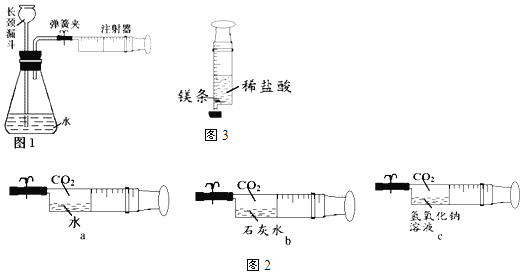
(1)验证碳酸钾存在:取少量实验一所得的晶体置于烧瓶中,按如图所示的装置实验,则试管中装的药品是_____,证明晶体中含有碳酸钾的实验现象是_____。烧瓶中发生反应的化学方程式是_____。
(2)验证硫酸钾存在:
甲同学取少量实验一所得的晶体于试管中,加蒸馏水溶解后,再加入氯化钡溶液,产生白色沉淀,于是他得出晶体中含有硫酸钾的结论。
乙同学认为,甲同学的方案不合理,其理由是:_____。
乙同学继续向甲同学所得白色沉淀中加入过量的_____,观察到_____,证明了晶体中硫酸钾的存在。
【答案】烧杯、漏斗、玻璃棒 防止局部温度过高造成液滴飞溅 澄清石灰水 试管中澄清石灰水变浑浊 K2CO3+2HCl=2KCl+H2O+CO2↑ 碳酸根也会与钡离子生成碳酸钡的白色沉淀 稀盐酸 白色沉淀未全部消失
【解析】
实验一:步骤③过滤用到的仪器是烧杯,玻璃棒,带铁圈的铁架台、漏斗、滤纸,其中玻璃仪器有烧杯、漏斗、玻璃棒;
步骤④蒸发用玻璃棒搅拌的目的是:防止局部温度过高造成液滴飞溅;
实验二:验证成分(1)检验碳酸根的方法是取样放入试管中,加入适量稀盐酸,若有能使澄清石灰水变浑浊的气体产生,则证明样品中含有碳酸盐。故试管中装的药品为:澄清石灰水,实验现象为:澄清石灰水变浑浊,烧瓶中碳酸钾与稀盐酸反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑;
(2)钡离子的沉淀既有硫酸钡的白色沉淀又有碳酸钡白色沉淀,故甲同学的方案不合理。因为碳酸根也会与钡离子生成碳酸钡的白色沉淀。碳酸钡遇到酸会反应,而硫酸钡则不与酸反应,故向甲同学所得白色沉淀中加入过量稀盐酸,观察到白色沉淀未全部消失,证明沉淀中有硫酸钡,晶体中有硫酸钾。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案