题目内容
(18分)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |
【探究一】:制备硫酸亚铁铵晶体

某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌。以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 。过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;

(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干。这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验。向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀。
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图所示。则:

(11)根据图示数据,硫酸亚铁铵晶体中,
x:y:z = ;
(12)写出A点到B点发生反应的化学方
程式 。
(1)乳化 △
(2)Fe + H2SO4==FeSO4 + H2↑
(3)漏斗 C
(4)防止FeSO4晶体析出 Cu
(5)c a
(6)AB(漏选不给分)
(8)使硫酸根完全沉淀(合理均给分)
(9)无沉淀
(10) xFeSO4·y(NH4)2SO4~ 2yNH3 ~ (x+y)BaSO4……………………(1分)
34y 233(x+y)
0.68g 9.32g
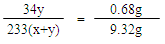
x:y=1:1……………………………………..(1分)
(11)1:1:6
(12)FeSO4·(NH4)2SO4·6H2O △ FeSO4·(NH4)2SO4·2H2O + 4H2O
解析试题分析:(1)洗涤剂除去油污是因为它含表面活性剂,表面活性剂要使油以极小的液滴均匀悬浮在水中形成乳浊液的现象。其中的乳化剂所起的作用就叫乳化作用。
(2)操作①向铁屑中加硫酸,二者反应的化学方程式为Fe + H2SO4==FeSO4 + H2↑;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒和漏斗。为了加快过滤速率,需要滤纸折叠后的表面积最大,所以应选择的折法是A;
(4)操作①中过滤时,如温度太低,硫酸亚铁的溶解度较低,其晶体会析出。所以要趁热进行。废铁屑中含一定量的铜,铜的活动性较弱不和稀硫酸反应,所以过滤后得到的固体中一定含有的物质是铜。
(5)硫酸亚铁铵晶体的溶解度较小,可通过加热浓缩而溶液浓度变大,促使形成硫酸亚铁铵的饱和溶液;然后再通过冷却结晶,使其从溶液中析出;再通过过滤分离出析出的晶体;最后洗涤干燥得到晶体。所以操作顺序是b→ c→ a →d;
(6)根据题意可知:硫酸亚铁铵晶体易溶于水,不溶于乙醇。所以操作②中使用乙醇洗涤,避免了用水洗涤所造成的晶体因溶解而损耗;且酒精易挥发,可低温晾干晶体。
【探究二】:(7)实验中生成的NH3极易溶于水,且能和水反应生成氨水,其溶液呈碱性,故能使湿润的 红色的石蕊试液变蓝;写出(NH4)2SO4与NaOH反应的化学方程式(NH4)2SO4 + 2NaOH == 2NH3 ↑+ Na2SO4 + 2H2O,此反应中(NH4)2SO4与NaOH两种反应物相互交换了成分,生成硫酸钠和氨水,氨水不稳定增长而分解为氨气和水。从类型上来说属于复分解反应;
(8)为使硫酸根完全沉淀,在实验中加入过量BaCl2溶液;
(9)洗涤沉淀是为了除去沉淀上带有的溶液中的离子,如未洗涤干净,则加入Na2SO4溶液能与过量有剩余的氯化钡反应生成沉淀。所以当加入Na2SO4溶液无沉淀生成,说明沉淀已经洗涤干净;
(10)方法一:根据题意可知:已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。解题思路:根据质量守恒定律可知,氮、硫两元素的质量在反应前后守恒。可根据生成氨气和硫酸钡沉淀的质量计算氮、硫元素的质量比;再根据晶体的化学式计算出氮、硫元素的质量比。二者相等,可计算出晶体中x 和y的比值。具体过程如下:
生成氨气0.68g,其中含氮元素的质量为:0.68g×(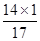 ×100%)=0.56g。
×100%)=0.56g。
生成硫酸钡9.32g,其中含钡硫元素的质量为:9.32g×(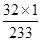 ×100%)=1.28g。
×100%)=1.28g。
根据质量守恒定律可知:氮、硫两元素在变化前后的质量相等。可列式为:
[14×2y]:[32×(x+y)] =0.56g:1.28g
则x:y=1:1
方法二:也可根据化学方程式计算此题。已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。
xFeSO4·y(NH4)2SO4~ 2yNH3 ~ (x+y)BaSO4
34y 233(x+y)
0.68g 9.32g
34y:233(x+y)= 0.68g:9.32g
x:y=1:1
(11)根据“硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去”可知生成水的质量为7.84g—5.68g=2.16g。结合(10)中的数据及晶体的化学式[xFeSO4·y(NH4)2SO4·zH2O]可列式为:[14×2y]:[32×(x+y)]:36=0.56g:1.28g:: 2.16g 所以 x:y:z=1:1:6
(12)根据图像可知:A点到B点发生反应是失去了结晶水的质量为7.84g—6.40g=1.44g。结合(11)可知结晶水的总质量为2.16g。设A点到B点发生反应是失去了结晶水的数目为x,则可列式为:x:6=1.44g:2.16g,可解得x=4 所以反应的化学方程式为:FeSO4·(NH4)2SO4·6H2O△FeSO4·(NH4)2SO4·2H2O + 4H2O
考点:乳化作用、科学探究、综合计算、化学方程式的书写

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( )
| A.4.4g | B.2.8g | C. 1.4g | D.0.8g |
 xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
 2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。
2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。