题目内容
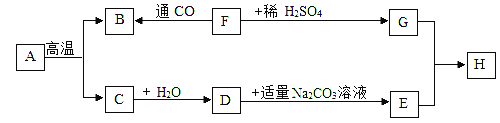
【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入二氧化碳 | 产生_____,红色消失 | 氢氧化钡溶液能与CO2反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式____________;同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀________(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠,②氢氧化钠、碳酸钠,③____________。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中,加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中,加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:___________;
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是___________;
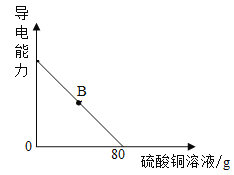
(4)向氢氧化钡溶液中滴加硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。当溶液处于B点时,所得溶液含有的微粒是_________(填微粒符号)。
【答案】无色酚酞 白色沉淀 Ba(OH)2+Na2CO3═BaCO3↓+2NaOH 不消失 氢氧化钠、氢氧化钡 ③ 加入过量稀盐酸 稀硫酸 Ba2+、OH-、H2O
【解析】
实验一:向氢氧化钡溶液中滴入酚酞试剂,酚酞遇碱性溶液变红,说明氢氧化钡溶液呈碱性;
实验二:向实验一的溶液中通入二氧化碳,(二氧化碳能与氢氧化钡反应产生碳酸钡沉淀和水)产生白色沉淀,红色消失,说明氢氧化钡溶液能与二氧化碳气体反应;
(1)实验三:氢氧化钡与碳酸钠反应产生碳酸钡沉淀和氢氧化钠的化学方程式:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;
探究一:向沉淀中加入足量的稀硫酸,(碳酸钡与稀盐酸反应产生氯化钡溶液和二氧化碳)观察到有气泡产生,最终沉淀消失。
探究二:
作出猜想:①氢氧化钠,②氢氧化钠、碳酸钠,③若氢氧化钡过量,则溶液中的溶质可能是:氢氧化钠、氢氧化钡;
实验五:取滤液样品于试管中,加入几滴碳酸钠溶液(碳酸钠能与氢氧化钡反应产生碳酸钡沉淀)若产生沉淀,说明溶液中含有氢氧化钡,猜想③成立;
(2)有同学提出:实验四的操作存在问题,加入稀盐酸的量太少,稀盐酸先与氢氧根反应产生水,被消耗完,没有与碳酸钠反应,导致结论不准确,改正:加入过量稀盐酸;观察是否有气泡产生,来确定是否有碳酸钠;
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是稀硫酸;稀硫酸能与氢氧化钡反应产生硫酸钡沉淀,能与碳酸钠反应产生二氧化碳气体;
(4)向氢氧化钡溶液中滴加硫酸铜溶液产生硫酸钡沉淀和氢氧化铜沉淀,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。当溶液处于B点时,氢氧化钡过量,所得溶液含有的微粒是:Ba2+、OH-;溶液中一定有水分子(H2O)。

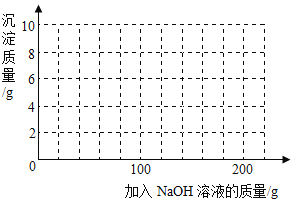
【题目】现有H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计如下实验方案:取四份混合溶液各100 g,分别缓慢加入到50 g、100 g、150 g、200 g某NaOH溶液中,测得四组实验数据如下表:
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
NaOH溶液的质量/g | 50 | 100 | 150 | 200 |
生成沉淀的质量/g | 0 | 2.45 | 7.35 | 9.8 |
(1)100 g混合溶液与NaOH溶液完全反应生成沉淀的质量为_______g。
(2)混合溶液中CuSO4的溶质质量分数是多少?(写出计算过程)
(3)混合溶液中H2SO4的溶质质量分数为___________。
(4)若在100 g混合溶液中不断加入上述NaOH的溶液,请画出加入NaOH溶液的质量与所产生沉淀质量的关系图。(在答题卡的坐标图中作图)