题目内容
【题目】现有H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计如下实验方案:取四份混合溶液各100 g,分别缓慢加入到50 g、100 g、150 g、200 g某NaOH溶液中,测得四组实验数据如下表:
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
NaOH溶液的质量/g | 50 | 100 | 150 | 200 |
生成沉淀的质量/g | 0 | 2.45 | 7.35 | 9.8 |
(1)100 g混合溶液与NaOH溶液完全反应生成沉淀的质量为_______g。
(2)混合溶液中CuSO4的溶质质量分数是多少?(写出计算过程)
(3)混合溶液中H2SO4的溶质质量分数为___________。
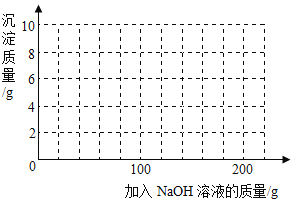
(4)若在100 g混合溶液中不断加入上述NaOH的溶液,请画出加入NaOH溶液的质量与所产生沉淀质量的关系图。(在答题卡的坐标图中作图)
【答案】(1)9.8;(2)16%;(3)7.35%;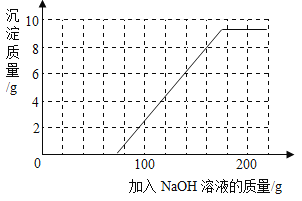
【解析】
(1)H2SO4与CuSO4的混合溶液,加入氢氧化钠溶液中,氢氧化钠先与硫酸反应生成硫酸钠和水,待硫酸完全反应后,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,由表中数据可知,氢氧化钠的质量为50g时,生成沉淀的质量是0,说明这时氢氧化钠只与硫酸发生了反应,氢氧化钠的质量为100g,生成沉淀的质量是2.45g,说明硫酸已经完全反应,氢氧化钠和硫酸铜开始反应,氢氧化钠的质量为150g时,生成沉淀的质量为7.35g,说明50g氢氧化钠溶液生成沉淀的质量是:7.35g-2.45g=4.9g,氢氧化钠的质量为200g时,生成沉淀的质量为9.8g,说明这时硫酸铜已经完全反应,故100 g混合溶液与NaOH溶液完全反应生成沉淀的质量为9.8g;
(2)设混合溶液中CuSO4的质量为x,消耗NaOH的质量为y
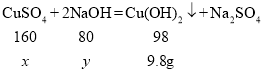
![]() x=16g
x=16g
![]() y=8g
y=8g
混合溶液中CuSO4的溶质质量分数为![]() ;
;
答:混合溶液中CuSO4的溶质质量分数是16%;
由第Ⅱ组和第Ⅲ组实验数据可知50 g NaOH溶液能生成沉淀质量:7.35 g - 2.45 g = 4.9 g,故生成9.8 g沉淀用掉NaOH溶液的质量是100 g,
NaOH溶液的溶质质量分数为![]() ;
;
(3)设混合溶液中H2SO4的质量分数为z,由第Ⅰ组、第Ⅱ组和第Ⅲ组实验数据可知H2SO4消耗的NaOH溶液的质量为75 g
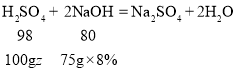
![]() z=7.35%
z=7.35%
答:混合溶液中H2SO4的溶质质量分数为7.35%;
(4)抓住起点、折点及曲线走势。曲线起点:H2SO4被完全反应后NaOH与CuSO4反应生成蓝色Cu(OH)2沉淀,H2SO4消耗的NaOH溶液的质量为75 g;曲线折点:溶液中CuSO4完全反应后再加入NaOH溶液,Cu(OH)2沉淀不再增加,此时所加入NaOH溶液的质量为100 g + 75 g = 175 g;曲线走势:加入175 g NaOH溶液后,CuSO4完全反应,随后再加入的NaOH溶液不再发生反应,Cu(OH)2沉淀的质量不变,故加入NaOH溶液的质量与所产生沉淀质量的关系图为: 。
。

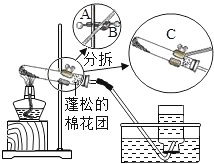
【题目】过氧化钠(Na2O2)是一种过氧化物,潜水艇常用过氧化钠作供氧剂,同时维持艇内空气成分的稳定。化学兴趣课上,同学们对过氧化钠(Na2O2) 可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
(提供资料)2Na2O2+2H2O=4NaOH+O2↑;二氧化碳与过氧化钠反应生成氧气和另一种物质。
①证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。
同学们在老师的指导下设计了如图所示装置:
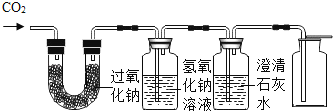
氢氧化钠溶液的作用是_____,若观察到_____,说明二氧化碳已经除尽。
②探究二氧化碳与过氧化钠反应生成的另一种物质。
(猜想与假设)下面是同学们提出的3种猜想。
猜想1:是氢氧化钠
猜想2:是碳酸氢钠
猜想3:是碳酸钠
通过对反应物的组成分析,小华认为猜想1和猜想2 是不正确的,理由是_____;过氧化钠与二氧化碳反应的化学方程式为_____。
(进行实验)同学们通过以下实验验证了另一种物质,请完成下述实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量CO2与Na2O2反应后的固体于试管中,_____。 | _____。 | 猜想3是正确的 |
【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入二氧化碳 | 产生_____,红色消失 | 氢氧化钡溶液能与CO2反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式____________;同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀________(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠,②氢氧化钠、碳酸钠,③____________。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中,加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中,加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:___________;
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是___________;
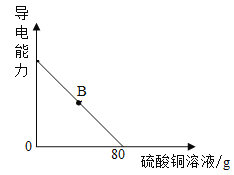
(4)向氢氧化钡溶液中滴加硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。当溶液处于B点时,所得溶液含有的微粒是_________(填微粒符号)。