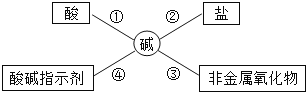
��Ŀ����
����Ŀ��ͭ���еش�����ɽ����ʯ��ʯ��Դ�ḻ��ij����С��ͬѧȡ����Ʒ12.0g���ձ��У���ʢ����Ʒ���ձ��м�������һ����������������ϡ������Һ��ַ�Ӧ������ϡ������������X��ʾ�����ձ���ʣ�������������Y��ʾ����ͼ��ʾ��ʯ��ʯ����Ҫ�ɷ���̼��ƣ����ʲ�����ˮҲ�����ᷴӦ������ش��������⣺
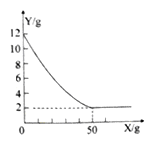
��1��ʯ��ʯ��̼��Ƶ������Ƕ��٣�
��2����ַ�Ӧ�����ɶ��ٶ�����̼��
��3������ϡ������������������Ƕ��٣�
���𰸡���1��10����2��7.3����3��14.6%
��������
�����������ͼʾ�������Ӧ��ȫ��ʣ��2�˵����ʣ����ʯ��ʯ��̼��Ƶ�������12g��2g=10g��
������в����Ķ�����̼������ΪX��ͬʱ��Ҫ�����������ΪY��
CaCO3 +2HCl=CaCl2 +H2O+CO2��
100 73 44
10g y x
�б���ʽ�ã�100:10��=73��Y=44��X ���X=4.4�� Y=7.3��
����ϡ������������������� 7.3�ˣ�50�ˡ�100%=14.6%

����Ŀ�����г����ʵķ�������ȷ����
ѡ�� | ����(������Ϊ����) | ���ӷ��� |
A | NaCl(Na2CO3) | ��������ϡ���ᣬ�����ᾧ |
B | KCl(MnO2) | �ܽ⣬���ˣ������ᾧ |
C | CO2(CO) | �ڿ����е�ȼ |
D | Cu (Fe) | ����������ϡ���ᣬ���� |