题目内容
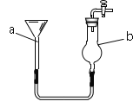
【题目】饮用水消毒是抑制传染病爆发的有效方法。漂白粉是常用的消毒剂,主要成分是次氯酸钙(Ca(ClO)2)和氯化钙易溶于水。如图为制取漂白粉的工业流程简图:
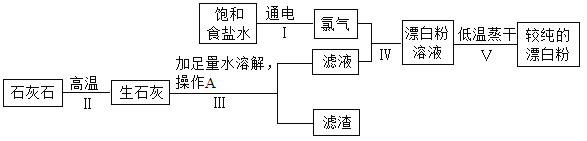
(1)写出步骤Ⅱ中碳酸钙高温分解为两种氧化物,化学反应方程式____________;次氯酸钙中氯元素的化合价为___.
(2)步骤Ⅲ加入足量水溶解主要发生的是___变化(填“物理”和“化学”);实验室进行操作A时,需要的玻璃仪器有烧杯、漏斗、___.
(3)饱和食盐水电解时发生如下反应:2NaCl+2H2O![]() 2X+H2↑+Cl2↑,请写出X的化学式________,写出食盐水的另一日常用途___________.
2X+H2↑+Cl2↑,请写出X的化学式________,写出食盐水的另一日常用途___________.
(4)通过步骤Ⅴ可以推测漂白粉具有的化学性质之一是__________.
【答案】CaCO3![]() CaO+CO2↑; +1; 化学; 玻璃棒。 NaOH; 腌制食品; 热稳定性差
CaO+CO2↑; +1; 化学; 玻璃棒。 NaOH; 腌制食品; 热稳定性差
【解析】
(1)碳酸钙分解生成氧化钙和二氧化碳,反应的化学反应方程式为:CaCO3![]() CaO+CO2↑;设次氯酸钙中氯元素的化合价为x,则有:(+2)+x×2+(-2)×2=0,x=+1;(2)步骤Ⅲ加入足量水时,水和氧化钙反应生成氢氧化钙,属于化学变化;实验室进行操作A(即过滤)时,需要的玻璃仪器有烧杯、漏斗、玻璃棒;
CaO+CO2↑;设次氯酸钙中氯元素的化合价为x,则有:(+2)+x×2+(-2)×2=0,x=+1;(2)步骤Ⅲ加入足量水时,水和氧化钙反应生成氢氧化钙,属于化学变化;实验室进行操作A(即过滤)时,需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)由2NaCl+2H2O![]() 2X+H2↑+Cl2↑可知,反应前后氯原子都是2个,反应前钠原子是2个,反应后应该是2个,包含在2X中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2X中,反应前氧原子是2个,反应后应该是2个,包含在2X中,因此X的化学式是NaOH;食盐水的另一日常用途是腌制食品;
2X+H2↑+Cl2↑可知,反应前后氯原子都是2个,反应前钠原子是2个,反应后应该是2个,包含在2X中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2X中,反应前氧原子是2个,反应后应该是2个,包含在2X中,因此X的化学式是NaOH;食盐水的另一日常用途是腌制食品;
(4)通过步骤Ⅴ可知,蒸发应该在低温条件下进行,说明漂白粉具有的化学性质之一是热稳定性差。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目