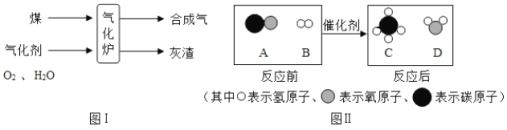
题目内容
【题目】对资料或实验证据的分析是否正确,直接关系到科学探究是否符合客观事实。下图为实验室用等质量的高锰酸钾和氯酸钾(另加少量的二氧化锰),分别制取氧气的数据分析示意图。下列依据图示信息所得出的分析正确的是( )
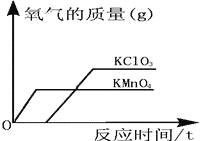
A. 同时开始加热,先收集到氧气的是氯酸钾
B. 用相同容积的试管制取较多量的氧气时,宜选择氯酸钾为原料
C. 加入少量的二氧化锰使氯酸钾产生的氧气质量增加
D. 反应时间较长的是高锰酸钾
【答案】B
【解析】
A. 观察图示可知,同时开始加热,先收集到氧气的是高锰酸钾,故错误;
B.因相同质量的氯酸钾和高锰酸钾制得氧气较多的是氯酸钾,所以用相同容积的试管制取较多量的氧气时,宜选择氯酸钾为原料较好,故制取;
C. 二氧化锰是催化剂,与生成氧气的多少无关,故错误;
D.通过观察图示可知,氯酸钾用时较长,故错误;
故选B

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】在老师的指导下,同学们进行了有趣的化学实验探究:
(一)测定空气中氧气含量
如图所示的是小亮同学用红磷在空气中燃烧的测定方法。过程是:
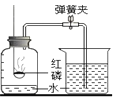
第1步:将集气瓶容积划分为五等份,并做好标记.
第2步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第3步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.请回答下列问题:
①第2步化学符号表达式_______________。
②实验完毕,若进入集气瓶中水的体积不到总容积的1/5,其原因可能是(_____)
A.集气瓶底部水占了一部分体积 B.红磷过少
C.没有完全冷却就打开了止水夹并计数 D.漏气
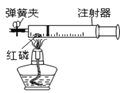
③小博同学对实验进行反思后,提出了改进方法(如图所示),小博在正式开始实验前,夹紧弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处.该操作的主要目的是_______________,你认为改进后的优点是________________ 。
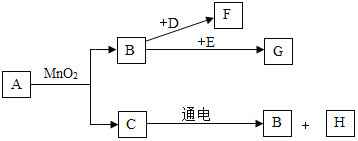
(二)小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | CuO 0.5g | |
③ | 1.2g | MnO2 0.5g |
上述实验应测量的“待测数据”是_______ .
②若实验②比实验①的“待测数据”________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解.
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是______,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃.小淳同学这样做目的是__________,
(预期结论)氧化铜也能作氯酸钾的催化剂.
(评价设计)你认为小余设计实验③和实验②对比的目的是____;写出实验②反应的表达式_____
(三)有趣的改进实验
利用如图装置进行“硫燃烧”的实验:用气卿(能不断鼓入空气的装置)不断地向弯型具支试管中鼓入空气,同时用酒精灯给硫粉加热至燃烧,移去酒精灯,可观察到微弱的淡蓝色火焰;然后停止鼓入空气,再用酒精灯给高锰酸钾加热,使硫在纯氧中继续燃烧,观察到________火焰.

写出实验中硫磺燃烧的化学反应表达式:_____.该实验装置的主要优点是在消除有害气体对环境污染的前提下有利于_____ .你推断烧杯中的氢氧化钠溶液的作用是______ .
【题目】某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液。为了测定此混合溶液中碳酸钠的质量分数,该同学设计如下实验:取此混合溶液53g,向其中滴加稀盐酸,当加入稀盐酸的质量为10g、20g、30g、40g时,生成气体的质量见下表(气体的溶解度忽略不计)。
第I组 | 第Π组 | 第Ⅲ组 | 第Ⅳ组 | |
稀盐酸的质量/g | 10 | 20 | 30 | 40 |
生成气体的质量/g | 0.9 | m | 2.2 | 2.2 |
请计算:
(1)第Π组数据m为_________;
(2)混合溶液中碳酸钠的质量分数是多少_____?