题目内容
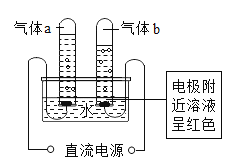
【题目】某同学设计的工业制备氢氧化钠的流程如下图。

资料: ,两电极,一端得到NaOH和H2,另一端得到Cl2。
,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)实验室进行蒸发操作时用到的仪器有铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒和________,蒸发过程中用玻璃棒不断搅动的目的是_________。
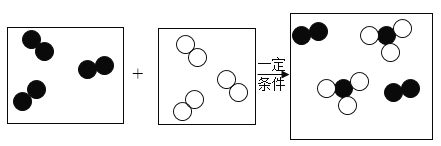
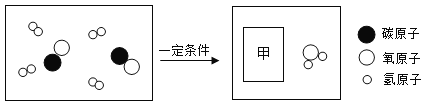
(2)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为![]() ,X的化学式为_______,反应前后氯元素的化合价共有________种。
,X的化学式为_______,反应前后氯元素的化合价共有________种。
(3)加热浓缩过程中(没有晶体析出),溶液中始终没有发生改变的量是_________。
【答案】蒸发皿 防止液体局部温度过高,造成液滴飞溅 H2O 3 溶质的质量
【解析】
(1)实验室进行蒸发操作时用到的仪器有铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒和蒸发皿,蒸发过程中用玻璃棒不断搅动的目的是防止液体局部温度过高,造成液滴飞溅,故填:蒸发皿;防止液体局部温度过高,造成液滴飞溅。
(2)化学反应![]() ,反应前氯、钠、氢、氧原子个数依次为2、2、2、2,反应后氯、钠、氧个数依次2、2、1,根据反应前后原子的种类数目不变,X当中含有2H、O,化学式为H2O,反应前氯气为单质氯元素化合价为零价,反应后NaCl中钠元素+1价,根据化合价代数和为零,氯元素-1价,设NaClO中氯元素化合价为x,根据化合价代数和为零,(+1)+x+(-2)=0,x=+1,故反应前后氯元素的化合价共有3种,故填:H2O;3。
,反应前氯、钠、氢、氧原子个数依次为2、2、2、2,反应后氯、钠、氧个数依次2、2、1,根据反应前后原子的种类数目不变,X当中含有2H、O,化学式为H2O,反应前氯气为单质氯元素化合价为零价,反应后NaCl中钠元素+1价,根据化合价代数和为零,氯元素-1价,设NaClO中氯元素化合价为x,根据化合价代数和为零,(+1)+x+(-2)=0,x=+1,故反应前后氯元素的化合价共有3种,故填:H2O;3。
(3)加热浓缩过程中(没有晶体析出),溶剂减少,溶液中始终没有发生改变的量是溶质的质量,故填:溶质的质量。

练习册系列答案
相关题目