题目内容
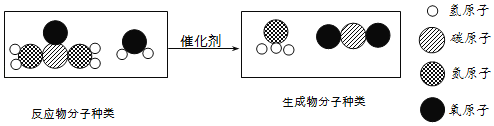
【题目】对于甲烷燃烧的化学方程式CH4+2O2![]() CO2+2H2O,下列理解错误的是( )
CO2+2H2O,下列理解错误的是( )
A. 甲烷和氧气在点燃的条件下反应生成二氧化碳和水
B. 参加反应的甲烷和氧气与反应生成的二氧化碳和水的分子个数之比为1∶2∶1∶2
C. 1个甲烷分子和2个氧气分子反应生成1个二氧化碳分子和2个水分子
D. 16 g甲烷和32 g氧气反应生成44 g二氧化碳和18 g水
【答案】D
【解析】
A、在反应中“+”读作“和”,该反应可读作:甲烷和氧气在点燃条件下,反应生成二氧化碳和水,故选项读法正确;
B、从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,参加反应的甲烷和氧气与反应生成的二氧化碳和水的分子个数之比为1∶2∶1∶2,故选项说法正确;
C、从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故选项说法正确;
D、由方程式可知每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成44份质量的二氧化碳和36份质量的水,则16 g甲烷和64 g氧气在点燃条件下能刚好完全反应,生成44 g二氧化碳和36 g水,故选项说法错误,故选D。

【题目】化学实验室常用二氧化锰催化过氧化氢分解的方法制取氧气。那么,影响过氧化氢分解快慢的因素到底有哪些呢?某化学兴趣小组对此进行如下研究。
(提出问题)影响过氧化氢分解快慢的因素有哪些?
(猜想与假设)假设1:过氧化氢溶液的浓度;
假设2:催化剂的质量;
假设3:温度;
假设4:_______。
(设计实验)小明同学设计如下实验方案进行验证。
序号 | H2O2溶液的浓度 | H2O2溶液的质量 | 温度 | MnO2的质量 | 收集O2的体积 | 时间 |
① | 5% | 12 g | 20 ℃ | 0.2 g | 125 mL | 20 s |
② | 30% | 12 g | 20 ℃ | 0.2 g | 125 mL | 2 s |
③ | 30% | 12 g | 40 ℃ | 无 | 125 mL | 148 s |
(1)通过对比实验①和②可知,过氧化氢分解的快慢与_______有关。
(2)在过氧化氢分解前后,二氧化锰的质量和_______不变。
(3)请你写出用二氧化锰催化过氧化氢分解的化学方程式:_______。
(讨论交流)(4)小红同学认为在这个实验中,必须用排水法收集氧气,理由是_______。
(5)小辉同学提出小明的方案无法验证温度对过氧化氢分解快慢的影响,请你帮他说出理由:____。
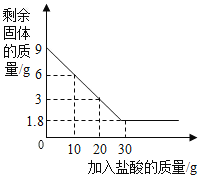
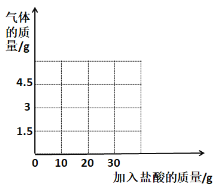
(拓展延伸)同学们查阅资料得知,FeCl3溶液对过氧化氢分解也有影响。在老师的指导下设计实验继续探究,向两支试管中分别加入等质量、不同浓度的H2O2溶液,再加入等质量、等浓度的FeCl3溶液,分别用气压传感器测定两试管中气体压力的变化曲线,如图1。
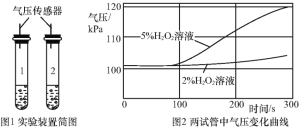
(6)为保证实验的准确性,请你设计向两试管中加入FeCl3溶液的具体方法:__。
(7)请你从图2曲线中找出FeCl3溶液对H2O2分解影响的两条规律性结论:__;____。
【题目】某班学生在老师指导下探究铁与水蒸气的反应。
(1)按图甲装好药品,连接装置(夹持仪器已略去)。其中A装置的作用是________。
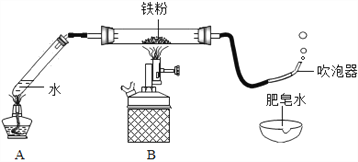
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式为_____________。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中FeO接触到空气会立即由黑色变为红棕色;铁的三种氧化物都不与硫酸铜溶液反应。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
倒出玻璃管中黑色固体,平铺于白纸上 | 黑色固体不变色 | 黑色固体中一定没有____(填物质名称) |
取上述黑色固体少许,装入试管,加入足量____溶液 | ________,且有红色固体出现 | 黑色固体中一定含有__________学科,网 |
【探究结论】铁与水蒸气发生置换反应,有关的化学方程式是_________。
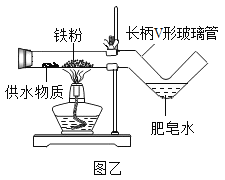
【拓展创新】同学们利用微型仪器“长柄V形玻璃管”改进了图甲装置,设计出图乙装置,并分别选用湿棉花、湿粉笔、芦荟叶、芭蕉茎、氢氧化镁、氢氧化铜等作为供水剂,实验都获得成功。
①甲、乙装置相比,乙装置有很多优点,请你写出一条:__________。
②分析上述供水剂的供水原理,其中正确的是______(填字母)
A.疏松、多孔的物质,有良好的吸水和保水性能
B.新鲜的富水植物,在受热时水分容易释放出来
C.本身不含水的固体物质,不能用作供水剂