题目内容
【题目】氨气(NH3)是一种重要的化工原料。
(1)氨气属于_____(填序号)。
A.混合物 B.纯净物 C.化合物 D.氧化物
(2)在高温和催化剂的条件下,可由氨气获得氢气,其反应类型与水电解制氢气相同。该反应的化学方程式为_____。
(3)尿素(CO(NH2)2)可以制氨气,反应的微观示意图如下:
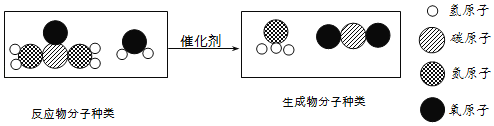
该反应的化学方程式为_____。
【答案】BC 2NH3![]() 3H2+N2 CO(NH2)2+H2O
3H2+N2 CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
【解析】
(1)氨气是由不同元素组成的纯净物,属于化合物,故填BC;
(2)氨气在高温和催化剂的条件下反应生成氢气和氮气,故反应的化学方程式写为:2NH3![]() 3H2+N2。
3H2+N2。
(3)由反应的微观示意图可知,尿素和水在催化剂的作用下生成了氨气和二氧化碳,故反应的化学方程式写为:CO(NH2)2+H2O![]() 2NH3+CO2。
2NH3+CO2。

 口算题天天练系列答案
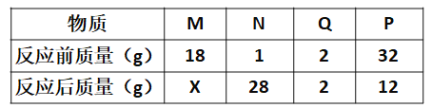
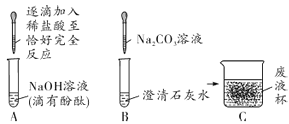
口算题天天练系列答案【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
I.不稳定性
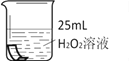
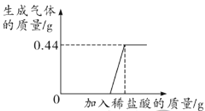
(1)如下图所示进行实验,过氧化氢分解的化学方程式为_______________,产生3.2g O2时分解的过氧化氢的质量为______ g。

(2)能用排水法收集O2的原因是______。
(3)探究温度对过氧化氢分解速率的影响
同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40min | 40min | 40 min |
由此得出的结论是_____________________________。
Ⅱ.腐蚀性
【查阅资料】H2O2溶液有腐蚀性。
【进行实验】
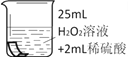
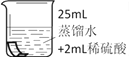
将铜片分别浸泡在3种溶液中进行实验,如下表。
编号 | ① | ② | ③ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
【解释与结论】
(4)实验①的作用是_____________________。
(5)铜片被腐蚀的反应如下,补全该反应的化学方程式。
Cu + H2O2+ H2SO4=== CuSO4 +_______。
【反思交流】
(6)某同学提出,实验②中,除发生(5)的反应外,还发生了一个反应导致有细小气泡产生,该反应的反应物为_______。
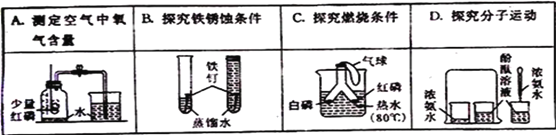
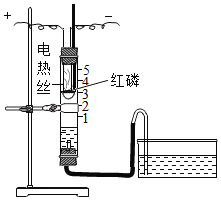
【题目】利用如图装置进行空气中氧气含量测定实验。
实验装置 | 实验操作 |
| I.向玻璃管和水槽内加适量的水,在燃烧匙里放足量红磷,塞紧塞子,上下移动水槽至两边水面相平于玻璃管的零刻度位置。 II.接通电源,待红磷燃烧,断开电源。 III.当温度恢复至室温,水不再进入玻璃管时,上下移动水槽至两边水面相平。 |
(1)实验中加入足量红磷的目的是_____,该实验中发生反应的化学方程式为_____。
(2)实验结束后,玻璃管内水面最终到达刻度线_____(填数字序号)处。
(3)实验操作I、III中,上下移动水槽至两边水面相平的目的是_____。